Производство противовирусного препарата молнупиравир будет запущено на одном из фармацевтических предприятий в городе Уитби, провинции Онтарио, в Канаде. Об этом сообщает ТАСС, ссылаясь на The Canadian Press
Американская компания Merck планирует инвестировать в это $19 млн. О сроках начала и масштабах производства не сообщается.
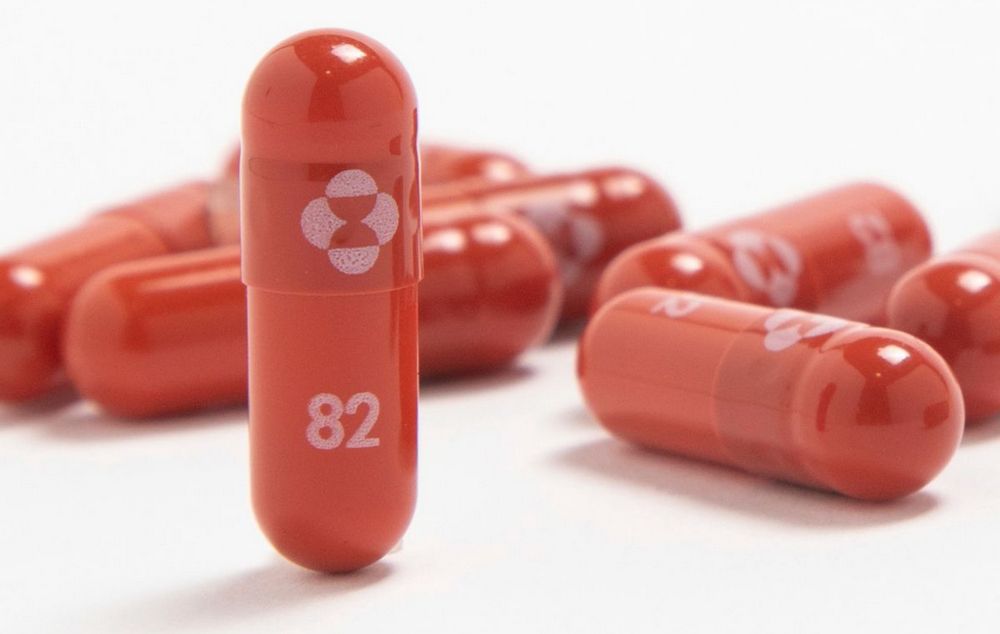
Молнупиравир — оральный препарат, созданный американскими компаниями Merck и Ridgeback Biotherapeutics. Отмечается, что через 24 часа вызывает резкое падение репликации SARS-CoV-2, снижает смертность на 48%.
Одобрение молнупиравира
4 ноября стало известно, что Британский регулятор MHRA (Агентство по контролю за лекарственными средствами и изделиями медицинского назначения) одобрил использование препарата молнупиравир, предназначенного для лечения больных COVID-19, сообщается в пресс-релизе агентства.
19 ноября регулятор ЕС также выдал рекомендацию на использование экспериментального противовирусного препарата, который первоначально создавался для лечения гриппа. В соответствии с ней, молнупиравир может использоваться для лечения взрослых пациентов, которым не требуется кислородная поддержка и которые подвержены повышенному риску развития тяжелых форм COVID-19. Лекарство должно применяться как можно скорее после выявления заболевания и не позднее, чем через пять дней после появления первых симптомов. Согласно предварительным данным испытаний препарата, опубликованных его производителем, применение молнупиравира позволяет на 50% снизить риск госпитализации инфицированных.
30 ноября консультативный совет при Управлении по вопросам качества продовольствия и медикаментов при Министерстве здравоохранения и социальных служб США (FDA) высказался за одобрение молнупиравира. При этом мнения членов совета по этой теме разделились почти поровну (13 — «за» и 10 — «против»). У некоторых из экспертов возникли вопросы к последним данным об испытаниях препарата и его эффективности. Окончательное решение FDA ожидается в ближайшие дни.