Центр оценки и исследования лекарственных средств Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (The U.S. Food and Drug Administration’s Center for Drug Evaluation and Research (CDER) одобрил в 2021 году 50 новых лекарственных средств, сообщается на сайте FDA.
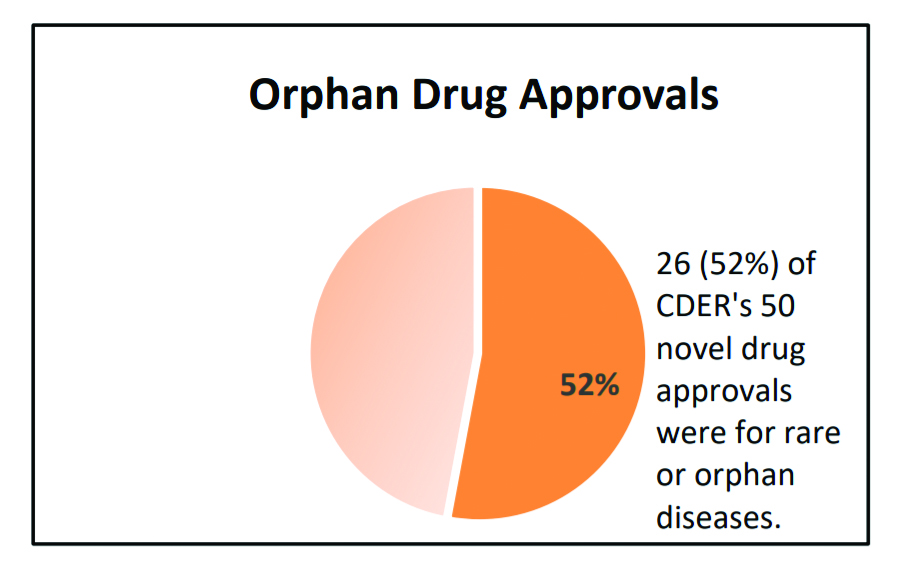
26 из 50, или 52% одобренных новых препаратов были направлены на лечение редких заболеваний, в том числе таких, как ахондроплазия (наиболее распространенная форма карликовости), истинная полицитемия (заболевание крови); мышечная дистрофия Дюшенна (заболевание, ведущее к прогрессирующей мышечной дистрофии), генерализованная миастения (хроническое нервно-мышечное заболевание, вызывающее слабость скелетных мышц) и болезнь Помпе (заболевание, характеризующееся дефицитом ферментов).
Кроме того, одобрение получили препараты для терапии редких видов рака, опухолей, связанные с болезнью фон Гиппеля-Линдау (наследственное заболевание, характеризующееся опухолями и кистами), амилоидоз легких цепей (рак, связанный с аномальным накоплением белка) и некоторых других видов.
В сообщении FDA подчеркивается, что пациенты с редкими заболеваниями часто остро нуждаются в новых методах лечения, поскольку у этих людей часто мало существующих вариантов лечения или они вообще отсутствуют.
В целом одобренные в 21-м году продукты направлены на такие заболевания и состояния, как:
- Заболевания сердца, крови, почек и эндокринной системы, включая лечение диабета, хронических заболеваний почек и хронического контроля веса.
- Аутоиммунные, воспалительные и легочные заболевания, такие как воспалительное заболевание кишечника и муковисцидоз.
- Неврологические состояния, такие как болезнь Альцгеймера, передозировка опиоидов и мигрень.
- Инфекционные заболевания, включая ВИЧ-1, оспу и цитомегаловирусную инфекцию.
- Различные виды рака, такие как рак легких, базально-клеточная карцинома, рак почки, рак молочной железы и рак желудка.
CDER также одобрил первые два взаимозаменяемых биоаналога в 2021 году, которые представляют собой биологические продукты, которые можно заменить без вмешательства врача. Больше биоаналогов и взаимозаменяемых биоаналогов на рынке означает усиление конкуренции, что может привести к расширению доступа к терапии и снижению затрат для пациентов.
По материалам FDA:
- Many Important Drugs Approved in 2021 as COVID-19 Pandemic Continues
- New Drug Therapy Approvals 2021. FDA’s Center for Drug Evaluation and Research. January 2022