
Заканчивается 2024 год. В обзоре за четвертый квартал представлена информация по инспектированию производителей ветеринарных препаратов на соответствие требованиям Правил надлежащей производственной практики (Good Manufacturing Practice, GMP). Эти инспекции проводят специалисты Органа инспекции Федерального государственного бюджетного учреждения «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГБУ «ВГНКИ»).
Иностранные производители
Согласно реестру заключений, опубликованному на сайте Россельхознадзора 28.12.2024 г. [1], в четвертом квартале этого года было выдано 11 заключений о соответствии требованиям Правил GMP. Эти заключения были сделаны в отношении площадок, расположенных в Бельгии, Бразилии, Венгрии, Испании, Италии, Португалии, Словении и США.
Наибольшее число российских инспекций, по результатам которых за 2017-2024 годы были приняты решения о выдаче/отказе в выдаче GMP-заключения, было проведено на производственных площадках, расположенных в Испании и Франции (суммарно 75, что составляет 29%).
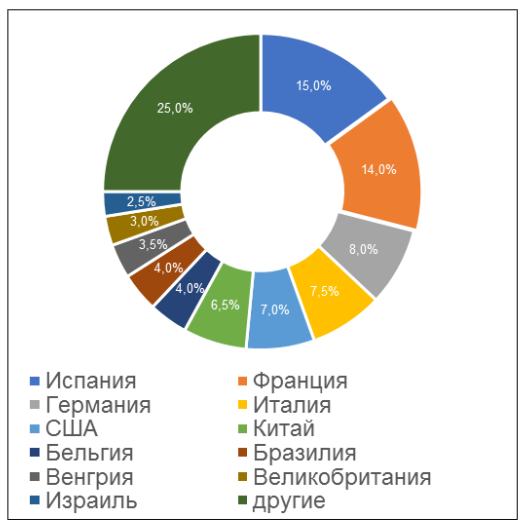
Советник директора ФГБУ «ВГНКИ» Данил Рудняев отметил продолжающееся сокращение числа дистанционных инспекций (всего было проведено 92 инспекции в онлайн формате). По его словам, проведение онлайн-инспектирования является временной мерой и не сможет в будущем полностью заменить формат инспектирования площадки с выездом специалистов на место осуществления ее деятельности [2].

Согласно реестру [1], к концу четвертого квартала количество действующих GMP-заключений увеличилось; несмотря на то, что срок действия трех из них истек (рост наблюдается в течение последних двух лет). На сегодняшний день зарубежные производители имеют 62 действующих GMP-заключения. Наибольшее количество заключений имеют производственные площадки, расположенные в Испании и Китае (суммарно 17, что составляет 27%).
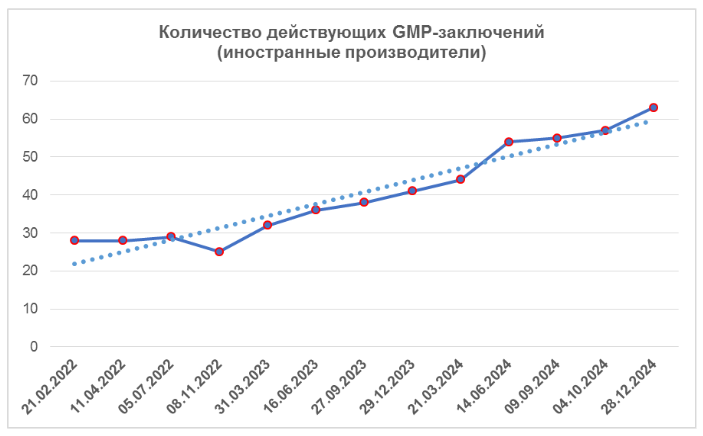
Анализ результатов инспектирования в тех странах, где было проведено наибольшее число российских инспекций, показывает тренды, похожие на тренды 2023года:
- худшие результаты у производственных площадок, расположенных в США, Германии и Бразилии (более 70% отказов в выдаче заключения);
- лучшие результаты у производственных площадок, расположенных в Израиле и Словении (ни одного отказа в выдаче заключения).
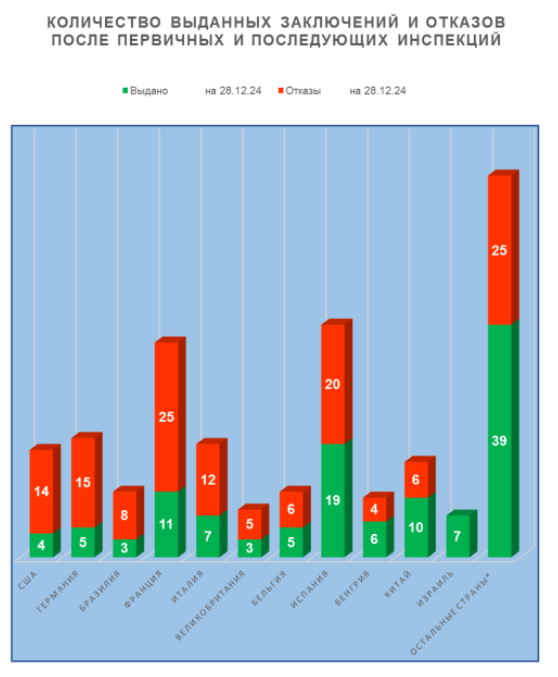
Количество выданных GMP-заключений и отказов после первичных и последующих инспекций, по странам (иностранные производители)
Наибольшее количество действующих GMP-заключений сейчас у производственных площадок и СМО компаний Elanco и Zoetis, расположенных в разных странах. По информации сайта «Зооинформ», в течение последних месяцев компания Elanco сосредоточила свои усилия на стабилизации ввоза в Россию критически важных ветеринарных препаратов и обеспечении соответствия своей продукции и производственных площадок нормативным требованиям российского законодательства [3]. Чешская компания Bioveta получила GMP-заключение еще в первой половине текущего года. Производитель готовился к прохождению инспекции на протяжении последних полутора лет. На производстве перестроили процессы, обновили оборудование, привели в соответствие всю документацию. Как сообщает сайт «Зооинформ», недавно эта компания принимала делегацию из России [4].
Комментируя объемы продаж ветеринарных препаратов на розничном рынке России, директор по развитию RNC Pharma Николай Беспалов особо отметил успехи словенской компании KRKA, продукция которой замещает отсутствующие на рынке препараты других производителей [5]. Недавно эта компания в очередной раз подтвердила соответствие деятельности двух своих словенских площадок требованиям Правил GMP ЕАЭС, утвержденных Решением Совета ЕЭК от 03.11.2016 г. № 77 [6]. Россия — одна из пяти стран, где KRKA располагает собственным фармацевтическим производством.
Следует отметить, что результаты ряда инспекций, проведенных во втором полугодии, могут стать известны только в первой половине 2025 года, поэтому итоги этого года еще могут измениться.
В соответствии с графиком проведения инспектирования, опубликованном на сайте ФГБУ «ВГНКИ» 17.12.2024 г. [7], на первое полугодие 2025 года уже запланировано 9 инспекций производителей ветеринарных препаратов, площадки которых расположены в Аргентине, Италии, Испании, Китае, Нидерландах, Уругвае и Франции.
Российские производители
Согласно реестру на сайте Россельхознадзора [1], в четвертом квартале текущего года было выдано 7 GMP-заключений. Эти заключения были получены производственными площадками АО «МОСАГРОГЕН», ООО НПП «АГРОФАРМ», ООО «АРЕАЛ МЕДИКАЛ», ФГБНУ «ФЦТРБ-ВНИВИ», ООО «НПФ ВИК», ООО «Т-ХЕЛПЕР КТ» и ООО «ВЕДА».
В целом за 2024 год российским производителям было выдано 11 заключений. На сегодняшний день отечественные производители имеют 31 действующее заключение.
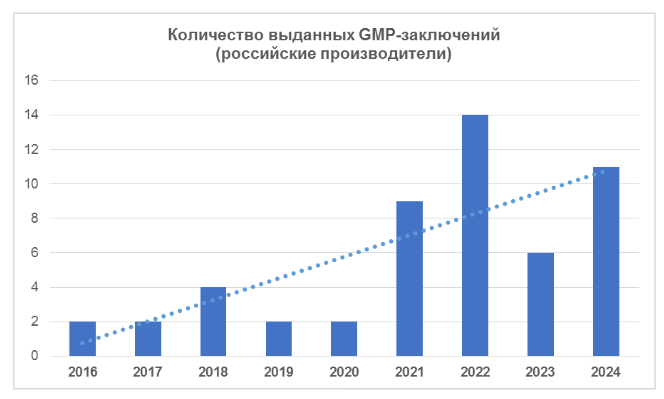
По информации начальника отдела нормативно-правового регулирования в сфере обращения лекарственных средств, кормов и кормовых добавок для животных Департамента ветеринарии Минсельхоза России Ксении Пугачевой, в настоящее время на территории Российской Федерации производство ветеринарных средств осуществляют 95 производителей, из которых 13% — это государственные организации, 87% — коммерческие организации. Российские производители наращивают объемы производства, в частности вакцин. По итогам первых десяти месяцев этого года объемы выпуска ветеринарных вакцин кратно превысили показатель 2023 года [5].
ПРОШЕДШИЕ СОБЫТИЯ И МЕРОПРИЯТИЯ
В четвертом квартале этого года прошло несколько событий и мероприятий, которые могли бы быть интересны производителям, готовящимся к инспектированию.
В октябре в Москве прошла VI Международная конференция «Логистика лекарственных средств» [8]. Всем участникам Конференции сообщество руководителей и специалистов по логистике и качеству SCM Pharm подарило Сборник практических статей GDP Review 5.
Среди представленных в сборнике материалов можно найти целых три статьи, посвященные теме температурных отклонений: «Температурные выходы при загрузке и выгрузке лекарственных средств в транспортное средство — чья зона ответственности?» [9], «Влияние температурных отклонений во время транспортировки на качество лекарственных средств» [10] и «Кратковременные отклонения температуры при дистрибуции лекарственных средств» [11].
Впервые в рамках Конференции состоялась отдельная сессия для производителей и дистрибьюторов ветеринарных препаратов — «Основные тенденции в транспортировке и хранении ветеринарной продукции. Маркировка и другие вызовы 2024 года». Спикерами круглого стола для ветеринарного сектора были начальник отдела организации государственного надзора в сфере обращения лекарственных средств для ветеринарного применения Управления государственного ветеринарного надзора Россельхознадзора Юлия Калинина, руководитель проектов ТГ Фарма ЦРПТ Вильнур Шагиахметов и управляющий директор фармацевтического 3PL-оператора NC Logistic Гарольд Власов. Подробнее о том, о чем спрашивали дистрибьюторы ветеринарных препаратов можно прочитать здесь.

Следует уточнить, что с ноября 2024 года вступил в силу Приказ Россельхознадзора от 11.09.2024 г. № 1175 [12], который вносит изменения в форму проверочных листов, применяемых Россельхознадзором и его территориальными органами при осуществлении федерального государственного контроля (надзора) в сфере обращения лекарственных средств для ветеринарного применения (Приказ от 03.02.2022 г. № 164). В частности, в список контрольных вопросов добавлен вопрос о соответствии производственных объектов требованиям Правил надлежащей дистрибьюторской практики (Good Distribution Practice, GDP) ЕАЭС, утвержденных Решением Совета ЕЭК от 03.11.2016 г. № 80 [13].
В ноябре в Москве состоялась 26-я международная выставка оборудования, сырья и технологий для фармацевтического производства Pharmtech & Ingredients 2024 [5]. Впервые на выставке в рамках деловой программы состоялся круглый стол, посвященный рынку ветеринарных препаратов — «Рынок лекарственных препаратов для ветеринарного применения: его особенности, проблемы и перспективы». Модератором мероприятия был Тимур Чибиляев, исполнительный директор Национальной ветеринарной ассоциации (НВА). С презентациями выступали представители ЕЭК, Министерства сельского хозяйства РФ, Россельхознадзора, ФГБУ «ВГНКИ», ЦРПТ, RNC Pharma, российских компаний-производителей ветеринарных препаратов.
Данил Рудняев выступил с презентацией на тему «Инспектирование с точки зрения инспектора. Опыт и проблемы при организации инспекции». Вначале он представил статистические данные по инспектированию и лицензионным проверкам производителей лекарственных средств для ветеринарного применения. Далее спикер остановился на основных вопросах, которые зарубежным и отечественным производителям следует проработать при организации инспекций и проверок. В конце своей презентации спикер привел перечень наиболее часто встречающихся несоответствий при инспектировании:
- Не осуществляется мониторинг аэрозольных частиц в чистых зонах классов А, В, С с целью фиксирования изменения уровня контаминации и любых ухудшений в работе системы (производители осуществляют мониторинг в зонах класса А, но в зонах В и С его не делают или делают не с той периодичностью, которая необходима).
- Не установлен срок хранения одежды для чистых помещений в стерильном состоянии (особенно это касается тех случаев, когда услуга по подготовке одежды передается на аутсорсинг).
- Не организован надлежащим образом контроль целостности и герметичности упаковок после их наполнения (во многих случаях такой контроль на предприятиях не проводится, несмотря на наличие доступных методов контроля).
- Валидация проведена не на трех последовательных сериях продукции в заданных параметрах (доказать, что количество валидационных серий может быть меньше трех, очень сложно).
- Протоколы валидации процесса производства не включают в себя требуемую информацию (например, обзор критических параметров процесса).
- Не учтена максимальная длительность кампании при проведении валидации очистки (например, по количеству серий продукции в кампании).

В декабре в Минске прошел Фармацевтический Форум Евразийского отделения ISPE. На площадке мероприятия представители ведущих фармацевтических компаний, представители регуляторных органов Республики Беларусь и Российской Федерации и другие эксперты отрасли обсудили наиболее актуальные вопросы, касающиеся производства лекарственных средств. Как отметил в своем выступлении Директор ФБУ «ГИЛС и НП» Владислав Шестаков, Евразийское отделение ISPE играет важную роль в объединении экспертов и содействии гармонизации международных требований к производству фармацевтической продукции в рамках Евразийского экономического союза [14].
Первым спикером после официального открытия Форума был Александр Мойсак, начальник Отдела надлежащей производственной практики Управления надлежащих фармацевтических практик Госфармнадзора РБ. В частности, он представил типичные несоответствия, которые были выявлены на проверяемых предприятиях фармацевтическим инспекторатом МЗ РБ [15].
На Форуме прошли сессии «Обновленное Приложение №1 GMP ЕС [16]: год с момента вступления в действие», «Совмещенное производство лекарственных средств и предотвращение рисков перекрестной контаминации: внедрение риск-ориентированного подхода», «Сценарий Фарма 4.0 в России: на пути к операционной эффективности и культуре непрерывных улучшений», а также деловая интерактивная игра, ориентированная на знание Правил GMP. Среди участников мероприятия были представители ветеринарного фармацевтического инспектората Государственного учреждения «Белорусский государственный ветеринарный центр» (ГУ «БГВЦ») и компаний-производителей ветеринарных препаратов (АВЗ, Материа Медика Холдинг, БелВитунифарм, Эланко, Сева Санте Анималь).

Диалог с экспертом

Оксана Пряничникова, Генеральный директор PQE CIS и Заместитель директора Евразийского отделения ISPE согласилась ответить на несколько вопросов, касающихся прошедшего Фармацевтического Форума.
Оксана, еще раз спасибо за приглашение на Форум в Беларуси. Скажи, пожалуйста, насколько сложно организовывать такие мероприятия и были ли трудности с организацией в 2024 году?
— Всегда сложно и всегда очень интересно. Ни я, ни Владимир Орлов, Директор отделения ISPE не являемся профессиональными организаторами мероприятий, у нас другая компетенция. Ввиду лимитированных ресурсов, практически все задачи, как в старт-апе мы реализуем сами, и каждый раз возникают новые вызовы.
Когда мы планировали проведение первой Конференции Евразийского отделения ISPE после признания в 2020 году, период попал на локдаун в Москве, и нам пришлось переносить мероприятие полностью в онлайн формат за 2 недели до события. Однако событие вызвало мощный интерес — более 1,5 тысяч уникальных подключений, 10 часов марафона сессий, мероприятие завершилось трансляцией «живого» онлайн тура по современной площадке в Бельгии.
В 2021 году мы реализовали гибридный формат в рамках трехдневного мероприятия с посещением двух производственных площадок в Калуге, а вот в 2022 году — фактически за месяц до события нам пришлось отменить мероприятие, которое было готово по всем параметрам на 99%, по независящим от нашей команды причинам. Это был удар, от которого нам было сложно оправиться, поэтому мы решили на время турбулентного периода ограничиться проведением камерных тематических мероприятий.
Тем не менее мы видели большой интерес от аудитории и решили рискнуть, не только возобновив проведение ежегодного мероприятия, но еще и осуществив его на территории другого государства. Наши мероприятия отличает готовность именитых иностранных спикеров — авторов руководств, активных членов тематических групп ISPE по различным темам организации фармацевтического производства и в то же время — топ менеджеров Большой Фармы, выступать на нашей площадке. Однако сейчас эта возможность ограничена из-за политик компаний, в которых спикеры работают, несмотря на сохранившиеся теплые персональные отношения.
Что интересно, после информационной кампании о проведении Форума в Беларуси, мы видели волну регистраций только из России, могла бы получиться курьезная ситуация, и только за 1,5 месяца до начала события производители из Беларуси откликнулись на событие с интересом. К сожалению, не удалось поменять зал на бо́льший формат, чтобы вместить всех желающих и нам пришлось закрыть регистрацию за месяц до начала события. В итоге, в мероприятии приняли участие 150 участников из 60 компаний России и Беларуси.
И ты, и Александр Белинский являетесь руководителями в подразделении крупной международной компании, то есть вы достаточно сильно занятые на основной работе сотрудники. Как вам удается совмещать работу в компании и ISPE ЕАЭС?
— Мы с Александром коллеги и соратники не только по деятельности в PQE и ISPE, более года мы реализуем технологический проект — разработку решения для автоматизации процессов по квалификации в GxP сфере. На текущий момент Программное обеспечение успешно прошло опытно промышленную эксплуатацию на крупном фармацевтическом предприятии в Санкт-Петербурге, внесено в реестр Роспатента и готово к коммерческому запуску. Пока есть энергия, интерес, вера в свои силы и будущее, роли корпоративных управленцев, технологических предпринимателей и общественных деятелей удается совмещать. Хотя у меня есть ощущение, что при бо́льшей возможности делегирования и поддержки, мы можем реализовать гораздо больше идей!
На прошедшем Форуме были представители регуляторных органов и уполномоченных учреждений двух стран ЕАЭС. Я знаю, что, например, в Конференции ISPE ЕАЭС 2021 принимал участие специалист подведомственного Россельхознадзору ФГБУ «ВНИИЗЖ» [17]. Считаешь ли ты необходимым для ISPE ЕАЭС развивать контакты с регуляторами и подведомственными учреждениями?
— Запрос со стороны отрасли точно есть, и мы надеемся, что мероприятия Евразийского отделения ISPE станут постоянной площадкой для такого диалога, по примеру международных конференций ISPE, где регуляторы всегда являются спикерами по проблемным вопросам.
Вы обращались к фармпроизводителям из Беларуси с предложением организовать посещение производственных участков участниками Форума. К сожалению, в этом году такую идею не удалось осуществить. Какую пользу могут принести такие визиты?
— При правильной организации и настрое, пользу от таких производственных визитов сложно переоценить. Это мощная синергия теории и практики, живой диалог и поиск решений, это новые социальные связи, развитие отраслевого кругозора и управление знаниями в масштабе предприятий.
Я до сих пор не могу забыть восхищенные отзывы делегатов Конференции ISPE ЕАЭС 2021 о таком новом для них опыте. И, конечно, на первом этапе планирования программы Форума в Минске мы имели намерение реализовать проект по организации визита на одно из предприятий Беларуси. В этот раз такую задачу осуществить не удалось по ряду причин, но два дня Форума были и так были достаточно насыщенными.
Планируете ли вы проведение Форума в следующем году, и могут ли активные специалисты фармацевтической отрасли предлагать актуальную повестку для возможного освещения на следующих событиях?
— Время научило нас быть осторожными в прогнозах, однако сразу после завершения мероприятия в Минске, мы с Владимиром Орловым и Александром Белинским начали формировать организационную концепцию Форума Евразийского отделения ISPE 2025. Мы будем верить, что наши планы и надежды исполняться и, конечно, нет ничего ценнее, чем предложения, задачи и идеи со стороны специалистов отрасли — их можно направить на адрес ispe@ispe.ru.
Производителям рекомендуется принимать активное участие в событиях и мероприятиях, связанных с GM(D)P, и тщательнее готовиться к инспектированию.
| Представленный материал подготовлен с использованием данных, актуальных на 28.12.2024 г. В случае получения новых или дополнительных данных статья может быть обновлена. |
Федеральное государственное бюджетное учреждение «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов», ФГБУ «ВГНКИ» — учреждение, уполномоченное Федеральной службой по ветеринарному и фитосанитарному надзору на проведение инспектирования производителей лекарственных средств для ветеринарного применения, производство которых осуществляется за пределами Российской Федерации, на соответствие требованиям Правил GMP
Федеральное бюджетное учреждение «Государственный институт лекарственных средств и надлежащих практик», ФБУ «ГИЛС и НП» — учреждение, уполномоченное на проведение инспектирования производителей лекарственных средств для медицинского применения, производство которых осуществляется за пределами Российской Федерации, на соответствие требованиям Правил GMP
Государственное учреждение «Белорусский государственный ветеринарный центр», ГУ «БГВЦ» — учреждение, уполномоченное Департаментом ветеринарного и продовольственного надзора Министерства сельского хозяйства и продовольствия Республики Беларусь на проведение фармацевтических инспекций производства ветеринарных лекарственных средств на соответствие требованиям Правил GMP
Национальная ветеринарная ассоциация, НВА — некоммерческая организация, которая является коллаборацией ключевых биофармацевтических компаний
Евразийское отделение ISPE, ISPE ЕАЭС — локальное отделение ISPE в Евразийском экономическом союзе, созданное для экспертной поддержки развития надлежащих практик в фармацевтической отрасли на территории ЕАЭС
ССЫЛКИ:
- Россельхознадзор / Деятельность / Госуслуги / Выдача заключения о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики / Дополнительная информация для заявителя / Государственный реестр заключений о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики. URL: https://fsvps.gov.ru/ru/gosuslugi/zaklyuchenie-o-sootvetstvii (дата обращения 28.12.2024)
- ФГБУ «ВГНКИ» / Пресс-центр / Новости / Сотрудники ФГБУ «ВГНКИ» приняли участие в круглом столе по ветпрепаратам на выставке Pharmtech & Ingredients-2024. URL: https://www.vgnki.ru/sotrudniki-fgbu-vgnki-prinyali-uchastie-v-kruglom-stole-po-vetpreparatam-na-vystavke-pharmtech-and-ingredients-2024.html (дата обращения 28.12.2024)
- Зооинформ / Фармкомпания Elanco продолжает поставки ветпрепаратов в Россию. URL: https://zooinform.ru/business/farmkompaniya-elanco-prodolzhaet-postavki-vetpreparatov-v-rossiyu/ (дата обращения 28.12.2024)
- Зооинформ / Фармкомпания Bioveta принимает гостей из России. URL: https://zooinform.ru/farmkompaniya-bioveta-prinimaet-gostej-iz-rossii/ (дата обращения 28.12.2024)
- ФармПром.РФ / Новости фармацевтической отрасли / Рынок лекарственных препаратов для ветеринарного применения: его особенности, проблемы и перспективы. URL: https://pharmprom.ru/rynok-lekarstvennyx-preparatov-dlya-veterinarnogo-primeneniya-ego-osobennosti-problemy-i-perspektivy/ (дата обращения 28.12.2024)
- Евразийский экономический союз / Решение Совета Евразийской экономической комиссии от 03.11.2016 г. № 77 «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза». URL: https://docs.eaeunion.org/docs/ru-ru/01411921/cncd_21112016_77 (дата обращения 28.12.2024)
- ФГБУ «ВГНКИ» / Структура / Отдел инспекции производства на соответствие требованиям надлежащей производственной практики / График проведения инспектирования иностранных производителей на соответствие требованиям надлежащей производственной практики. URL: https://www.vgnki.ru/otdel-inspekcii-proizvodstva-na-sootvetstvie-trebovaniyam-nadlezhashhej-proizvodstvennoj-praktiki.html (дата обращения 28.12.2024)
- SCM Pharm / Мероприятия / VI Международная конференция Логистика лекарственных средств. URL: https://scmpharm.ru/events/6-offline-conf/ (дата обращения 28.12.2024)
- ФармПром.РФ / Экспертный материал / Температурные выходы при загрузках и выгрузках лекарственных средств в транспортное средство – чья зона ответственности? URL: https://pharmprom.ru/temperaturnye-vyxody-pri-zagruzkax-i-vygruzkax-lekarstvennyx-sredstv-v-transportnoe-sredstvo-chya-zona-otvetstvennosti/ (дата обращения 28.12.2024)
- ФармПром.РФ / Экспертный материал / Влияние температурных отклонений во время транспортировки на качество лекарственных средств. URL: https://pharmprom.ru/vliyanie-temperaturnyx-otklonenij-vo-vremya-transportirovki-na-kachestvo-lekarstvennyx-sredstv/ (дата обращения 28.12.2024)
- ФармПром.РФ / Экспертный материал / Кратковременные отклонения температуры при дистрибуции лекарственных средств. URL: https://pharmprom.ru/kratkovremennye-otkloneniya-temperatury-pri-distribucii-lekarstvennyx-sredstv/ (дата обращения 28.12.2024)
- Официальный интернет-портал правовой информации / Приказ Федеральной службы по ветеринарному и фитосанитарному надзору от 11.09.2024 № 1175 «О внесении изменений в приказ Федеральной службы по ветеринарному и фитосанитарному надзору от 3 февраля 2022 г. № 164 «Об утверждении форм проверочных листов (список контрольных вопросов), применяемых Федеральной службой по ветеринарному и фитосанитарному надзору и ее территориальными органами при осуществлении федерального государственного контроля (надзора) в сфере обращения лекарственных средств для ветеринарного применения». URL: http://publication.pravo.gov.ru/document/0001202411070017?index=1 (дата обращения 28.12.2024)
- Евразийский экономический союз / Решение Совета Евразийской экономической комиссии от 03.11.2016 г. № 80 «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза». URL: https://docs.eaeunion.org/docs/ru-ru/01411930/cncd_21112016_80 (дата обращения 28.12.2024)
- ФБУ «ГИЛС и НП / Новости / 2024 / В Минске стартовал Форум ISPE ЕАЭС. URL: https://gilsinp.ru/news/v-minske-startoval-forum-ispe-eaes/# (дата обращения 28.12.2024)
- ФармПром.РФ / Новости фармацевтической отрасли / Белорусский фарминспекторат представил данные о типичных несоответствиях на Форуме ISPE ЕАЭС в Минске. URL: https://pharmprom.ru/belorusskij-farminspektorat-predstavil-dannye-o-tipichnyx-nesootvetstviyax-na-forume-ispe-eaes-v-minske/ (дата обращения 28.12.2024)
- The rules governing medicinal products in the European Union — Volume 4 — EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use / Annex 1 — Manufacture of Sterile Medicinal Products. URL: https://health.ec.europa.eu/system/files/2022-08/20220825_gmp-an1_en_0.pdf (дата обращения 28.12.2024)
- Россельхознадзор / Региональные новости / Специалист ФГБУ «ВНИИЗЖ» принял участие в конференции «ISPE ЕАЭС — 2021» Евразийского отделения ISPE. URL: https://fsvps.gov.ru/news/specialist-fgbu-vniizzh-prinjal-uchastie-v-konferencii-ispe-eajes-2021-evrazijskogo-otdelenija-ispe/ (дата обращения 28.12.2024)


