
Амджен,
старший менеджер,
международное качество и
дистрибьюция
В данной статье мы рассмотрим некоторые особенности подготовки и прохождения дистанционных GMP инспекций со стороны Заявителя и Производителя на основании опыта, накопленного за последние два года, с тех пор как появились ограничения на посещение площадок зарубежных производителей в связи с пандемией.
(3) Заявителем на получение государственной услуги является юридическое лицо: производитель лекарственных средств для медицинского применения, производство которых осуществляется в Российской Федерации (производитель), или производители лекарственных средств для медицинского применения, производство которых осуществляется за пределами Российской Федерации (иностранный производитель), либо их уполномоченные представители.
На данный момент ситуация с проведением дистанционных GMP инспекций продолжает быть актуальной и такие инспекции остаются востребованным инструментом проведения оценки производственных площадок иностранных производителей на соответствие требованиям Правил надлежащей производственной практики со стороны регуляторного органа.

Амджен,
менеджер, международное
качество и дистрибьюция
«Федеральное бюджетное учреждение «Государственный институт лекарственных средств и надлежащих практик» (ФБУ «ГИЛС и НП») с 2015 года уполномочено на проведение инспектирования производителей (*) лекарственных средств для медицинского применения, производство которых осуществляется за пределами Российской Федерации, на соответствие требованиям правил GMP в целях выдачи заключений о соответствии производителя лекарственных средств требованиям правил надлежащей производственной практики» (1) для Министерства промышленности и торговли Российской Федерации и является его подведомственным учреждением. Институт ФБУ «ГИЛС и НП» был основан в 1973 году и является крупной научно-исследовательской базой в сфере фармации. Министерство промышленности и торговли Российской Федерации на основании инспекционного отчёта принимает решение о выдачи или отказе в выдаче сертификата GMP.
С 2015 года по настоящий момент ФБУ «ГИЛС и НП» провёл по национальной процедуре, утверждённой в РФ, более 700 инспекций производителей, находящихся на территории РФ, и более 2000 — за её пределами, а также по процедуре ЕАЭС более 200 — на территории РФ и более 150 — за её пределами.
На данный момент допускается проведение инспекций по национальной процедуре, утверждённой в РФ, и по процедуре ЕАЭС. Однако в связи с продолжающейся интеграцией стран СНГ в Евразийский Экономический Союз национальная процедура постепенно отходит на второй план.
Ниже собраны нормативные документы, регламентирующие инспекции, которыми руководствуется в своей работе ФБУ «ГИЛС и НП» (1).
По национальной процедуре Российской Федерации:
- Приказ Минпромторга России от 21.12.2015 № 4184 «Об определении федерального бюджетного учреждения «Государственный институт лекарственных средств и надлежащих практик» Министерства промышленности и торговли РФ уполномоченными учреждением на проведение инспектирования»;
- Приказ Минпромторга России от 04.02.2016 N 261 «Об утверждении форм заявления о выдаче заключения о соответствии производителя (иностранного производителя) лекарственных средств для медицинского применения требованиям правил надлежащей производственной практики, инспекционного отчёта по результатам инспектирования производителя и иностранного производителя лекарственных средств для медицинского применения на соответствие требованиям правил надлежащей производственной практики и заключения о соответствии производителя (иностранного производителя) лекарственных средств для медицинского применения требованиям правил надлежащей производственной практики»;
- Приказ от 26 мая 2016 года N 1714 «Об утверждении административного регламента Министерства промышленности и торговли РФ по предоставлению государственной услуги по выдаче заключений о соответствии производителей лекарственных средств для медицинского применения требованиям правил надлежащей производственной практики».
По процедуре ЕАЭС:
- Решение № 83 от 03.11.2016 года «Об утверждении Правил проведения фармацевтических инспекций»;
- ПРИКАЗ от 4 сентября 2020 года N 2945 «Об утверждении административного регламента Министерства промышленности и торговли РФ по предоставлению государственной услуги по выдаче заключений о соответствии производителей лекарственных средств для медицинского применения требованиям правил надлежащей производственной практики Евразийского экономического союза».
Инспекции проводятся на соответствие производителя нижеуказанным документам:
- Приказ Минпромторга России от 14.06.2013 N 916 «Об утверждении Правил организации производства и контроля качества лекарственных средств»;
- Решение № 77 от 03.11.2016 «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза».
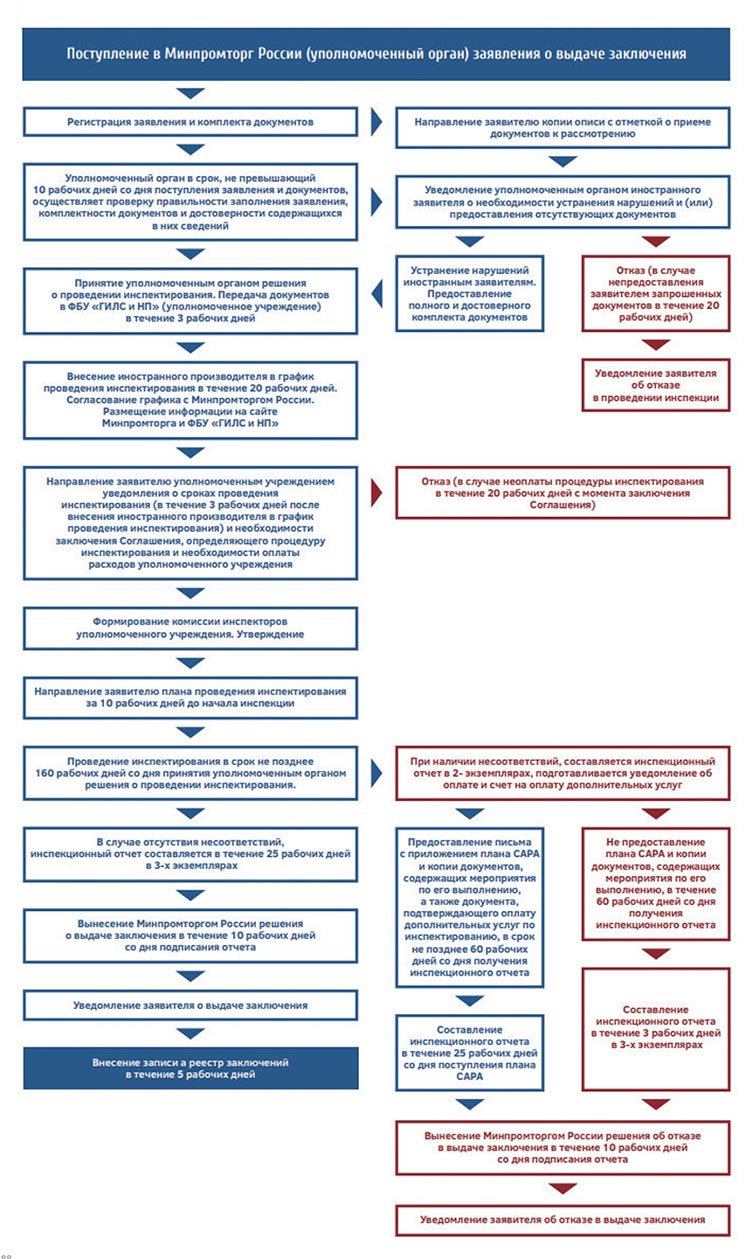
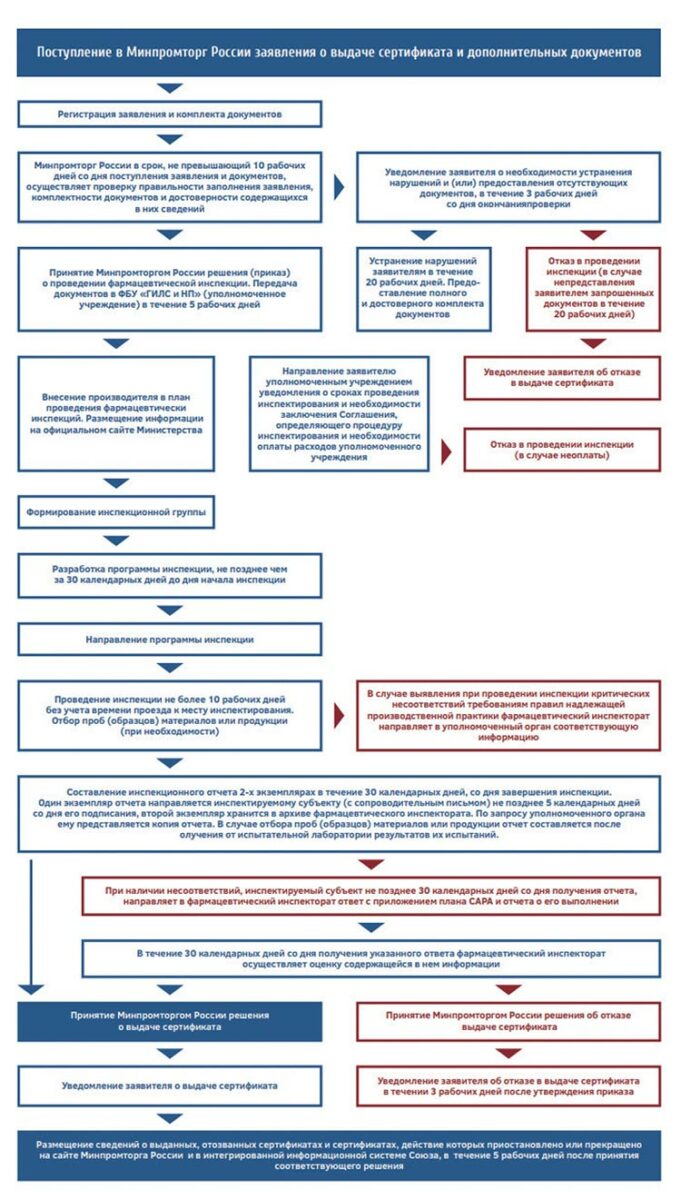
Ниже приведены Блок-схемы алгоритмов инспектирования (1)
GMP РФ
GMP ЕАЭС
С 2015 года и до марта 2020 года GMP инспекции проводились непосредственно на заводе производителя. Однако с момента наступления ограничений, связанных с COVID-19, процесс проведения инспектирования стал дистанционным. Дистанционное инспектирование зарубежных площадок продолжается и на сегодняшний день.
Виртуальные инспекции имеют ряд ограничений, занимают больше времени и, соответственно, требуют тщательной подготовки со стороны Заявителя и производителя. Важная роль во время подготовки и проведения инспекции отводится IT-специалистам: необходимо обеспечить беспрепятственную коммуникацию и организовать онлайн-трансляции.
Эффективность и успешность инспекции с использованием средств дистанционного взаимодействия зависит в том числе от качества и уровня используемых информационных технологий. Ключевыми элементами, которые следует учитывать при подготовке к инспекции, помимо технической осуществимости, являются безопасность и конфиденциальность удалённых подключений. Необходимо заранее проработать возможные юридические проблемы и запросы на выполнение видеозаписей и представление документации на электронных носителях. Настоятельно рекомендуется, чтобы IT-специалист участвовал в подготовке и был доступен для поддержки технологических аспектов во время дистанционных инспекций. Следует определить, согласовать и установить безопасные пути для обмена документацией и передачи файлов. Рекомендуется заранее, до начала инспекции, провести предварительное тестирование доступа к информационным системам для видеосвязи и обмена документацией.
Подготовка к инспекции со стороны Заявителя и Площадки-производителя
- После подачи необходимого комплекта документов для регистрации заявки на проведение инспектирования с ответственным лицом (определяется компанией-заявителем) свяжется сотрудник ФБУ «ГИЛС и НП» для согласования дат инспекции производителя. Это может быть как ваша (здесь и далее подразумевается ваша компания-заявитель) площадка на территории РФ или за её пределами, так и ваш контрактный производитель. Ответственному лицу необходимо согласовать с площадкой даты инспекции, чтобы площадка зарезервировала даты под предстоящую инспекцию.
Возможна ситуация, когда на заранее согласованные даты инспекции наслаивается другая внеплановая инспекция (например, местного органа здравоохранения). В этом случае Заявителю необходимо обсудить данную ситуацию с площадкой и инспекторатом ГИЛС и НП для поиска решения, устраивающего обе стороны (н/р, смещение инспекции, гибридный формат инспекции (документарная + дистанционная).
- Не менее чем за 10 дней до начала запланированной инспекции ФБУ «ГИЛС и НП» направляет Заявителю Программу инспекции на русском языке. Данная программа содержит график инспекции и перечень документов, которые площадке необходимо представить инспекторам к началу инспекции. На данном этапе задача Заявителя — представить полученную Программу контактному лицу производственной площадки, которое отвечает за инспектирование, включая перевод Программы на английский язык.
- Дополнительно полезной практикой, особенно если площадка принимает инспекцию впервые или после длительного перерыва, является организация звонка между Заявителем и площадкой, когда стороны могут обсудить предстоящую инспекцию и необходимые приготовления.
Со стороны Заявителя необходимо сообщить площадке следующие важные аспекты:
- дополнительно проинформировать площадку о предполагаемых датах инспекции, ознакомить её с объёмом инспекции (кем и для каких целей проводится инспекция; нормативные требования, по которым проводится инспекция; перечень продуктов и производственных стадий, в отношении которых проводится инспекция; результаты предыдущей инспекции и статус выполненных корректирующих и предупреждающих действий по устранению замечаний предыдущей инспекции (если замечания были); классификация замечаний и последствия наличия замечаний и процесс их устранения);
- удостовериться, что площадка понимает требование, что все запрошенные в Программе инспекции документы приравниваются инспекторами к предварительному запросу, и данные документы необходимо загрузить в облачное хранилище (например, Sharepoint, Box и т.д.) и предоставить доступ инспекторам к данному хранилищу до начала инспекции. Следует заранее, за несколько дней до начала инспекции, удостовериться, что у инспекторов есть доступ к документам и документы могут быть открыты;
- запрошенные в Программе документы должны быть представлены на английском или русском языках. В случае, если документы у производственной площадки ведутся на языке, отличном от английского или русского, необходимо организовать их перевод;
- следует уделить внимание вопросу конфиденциальности: в зависимости от внутренних политик компании может потребоваться дополнительное согласование возможности представления электронных копий документов и видеоматериалов. Также необходимо следовать местному законодательству в отношении видеосъёмки сотрудников;
- необходимость для площадки обеспечить наличие переводчиков на русский язык на время телеконференций с инспекторами. Следует отдавать предпочтение переводчикам, владеющим профессиональной терминологией. Обычно одного, двух переводчиков достаточно для поддержания инспекции.
Обычно у производственной площадки уже имеется опыт прохождения инспекций различных регуляторных органов (как минимум инспекций в традиционном формате с присутствием инспекторов на площадке) и существуют отработанные процессы по подготовке и проведению инспекции (создание координационной группы по ведению инспекции, подготовке документов, обработке поступающих запросов и презентации ответов). Данный опыт должен быть использован и при дистанционной инспекции.
В период с получения Программы инспекции и до момента начала инспекции площадка выполняет подготовку запрошенных документов. При необходимости возникающие вопросы могут быть уточнены с инспекторами через Заявителя. Возможной опцией является организация встречи площадки и инспекторов для обсуждения организационных моментов до начала инспекции (особенно в случае проведения совмещённой инспекции контрактного производителя для нескольких компаний Заявителей).
Стандартной практикой проведения инспекции с использованием средств дистанционного взаимодействия является организация виртуального общения инспектируемой площадки и инспекторов. Видеосвязь обеспечивает лучшую коммуникацию во время инспекции. Рекомендуется использовать такие системы, которые позволяют всем участникам знать, кто подключён, и иметь возможность визуализировать совместно используемый контент (например, Webex, Teams, Zoom). Формат дистанционной инспекции предполагает, что большую часть времени инспектора самостоятельно изучают представленную документацию, а также дополнительно запрошенные данные и документы. Дополнительно заранее организуются видеоконференции. Сеансы видеосвязи обычно планируются для открывающей встречи — вступительного совещания, которое проводится в первый день инспекции, демонстрации производственной площадки, видеовстреч представителей площадки и инспекторов, которые планируются на протяжении инспекции для обсуждения открытых вопросов, а также — заключительного совещания.
Во время вступительного совещания, помимо представления участников инспекции, презентации производственной площадки и проверки данных геолокации, обсуждаются организационные моменты, такие как обзор процесса коммуникации, расписания инспекции и т.д.
Обязательным требованием в рамках проводимой инспекции является демонстрация производственной площадки, которая включает:
- складские зоны,
- зоны отбора проб,
- лаборатории качества,
- производственные помещения и
- оборудование, задействованные в ходе производства и тестирования лекарственного препарата, заявленного на инспектирование.
Демонстрация проводится посредством организации виртуального видеотура, когда представитель площадки ведёт видеотрансляцию в режиме «онлайн» непосредственно из помещений площадки либо посредством демонстрации предварительно записанного видео на видеоконференции с сопутствующими комментариями по содержимому снятого материала. По предварительному согласованию, площадка может предоставить заранее подготовленное видео инспекторам для самостоятельного изучения и представить сопутствующие комментарии на отдельном звонке, если они потребуются. В рамках подготовки к инспекции следует заранее определить предпочтительный формат демонстрации с учётом локальных требований и внутренних политик инспектируемой площадки и согласовать его с инспекторами (например, внутренняя политика инспектируемого объекта может не допускать выполнение и предоставление видеозаписей производственных помещений). Для более эффективного представления производственной площадки следует заранее определить помещения и процессы, которые будут представлены, и представить инспекторам планы помещений и схему производственного процесса. Во время демонстрации следует показывать номер помещения и общего вида помещения с установленным оборудованием.
Формат видеозвонков для обсуждения открытых вопросов аналогичен формату интервью во время выездной инспекции, когда ответственные сотрудники представляют ответы на поставленные инспекторами вопросы. Формат видеозвонков должен допускать демонстрацию на экране документов/презентаций для более эффективного обмена информацией. При ответах следует учитывать факт работы переводчика – не строить длинных фраз и делать паузы после предложений, по возможности не использовать аббревиатуры и акронимы или, по крайней мере, давать их расшифровки. Данный подход позволит максимально точно выполнить перевод и избежать недопонимания между площадкой и инспекторами.
Важным аспектом работы со стороны Заявителя является обеспечение эффективной коммуникации инспекторов и площадки. В конце каждого дня проведения фармацевтической инспекции от инспекторов поступает список с новыми вопросами на русском языке, а также перечень дополнительной необходимой документации. В этом случае Заявителю следует своевременно перенаправлять данные запросы на площадку (выполняя перевод на английский язык, если существует такая договорённость с площадкой), а также предоставлять обратную связь инспекторам по статусу выполнения запроса. В случае совмещённой инспекции контрактного производителя на основании заявлений от разных компаний-заявителей инспектора могут работать с инспектируемой производственной площадкой напрямую и в этом случае направлять запросы непосредственно площадке, минуя Заявителя.
Во время заключительного совещания подводятся итоги проведённой инспекции: инспекционной группой оглашаются выявленные несоответствия, а также обсуждаются актуальные вопросы и дополнительная документация, которая может быть представлена инспектируемым субъектом по согласованию с инспекторатом.
В течение, но не позднее последующих 30 календарных дней со дня окончания инспектирования инспекторами выполняется подготовка инспекционного отчёта. Во время этого промежутка времени необходимо сохранять предоставленный инспекторам доступ к облачному хранилищу с документами. Также со стороны инспекторов могут быть заданы дополнительные вопросы и запрошены дополнительные документы, которые необходимо будет своевременно предоставить инспекторам.
Дополнительным требованием по окончании инспекции является представление Заявителем всей документации, указанной в Плане инспектирования, а также документации, запрошенной комиссией инспекторов в течение инспектирования, в ФБУ «ГИЛС и НП» в виде заверенных копий документов на бумажном носителе или записанных на DVD диски (2 копии). Данная документация передаётся совместно с сопроводительным письмом. Следует заранее сообщить об этом инспектируемой площадке, чтобы при необходимости инициировать процесс для согласования предоставления данной информации.
Может сложиться ситуация, когда площадка физически не может отправить диски с документами в инспекторат. В данном случае Заявитель, находящийся в РФ, может выполнить запись документов на диск и передать в инспекторат. Дополнительной опцией может являться согласование с инспекторами возможности отсрочки в представлении документов на дисках.
По факту получения готового инспекционного отчёта существуют 2 сценария развития событий:
- Если инспекционный отчёт не содержит несоответствий и содержит заключение о соответствии производственной площадки требованиям Правил надлежащей производственной практики, то на основании данного отчёта принимается решение о выдаче сертификата Минпромторгом.
- В случае, если в инспекционном отчёте указаны несоответствия (Краткая справка по классификации несоответствий приведена ниже), выявленные при проведении инспекции, инспектируемый субъект не позднее 30 календарных дней со дня получения отчёта имеет возможность представить ответ с приложением плана корректирующих и предупреждающих действий и отчёта о его выполнении совместно с подписанным дополнительным соглашением на оценку плана корректирующих и предупреждающих действий и отчёта о его выполнении и документом, подтверждающим оплату счёта.
В этом случае в течение последующих 30 календарных дней со дня получения указанного ответа фармацевтический инспекторат осуществляет оценку предоставленной информации, принимает решение о возможности снятия указанных несоответствий и подготавливает финальную версию отчёта, которая представляется заявителю. В случае принятия инспекторатом документальных свидетельств, подтверждающих выполнение корректирующих и предупреждающих действий, повторная (контрольная) инспекция может не проводиться. Cертификат GMP выдаётся при условии устранения всех критических и существенных несоответствий, а также прочих несоответствий, если в совокупности они представляют собой существенные несоответствия.
В заключение хотим сказать, что прохождение удалённых инспекций, на наш взгляд, сложнее, чем прохождение инспекции непосредственно на площадке. Удалённые инспекции требуют более комплексного подхода и дополнительного вовлечения таких сотрудников, как юридический отдел и отдел контроля за соблюдением законодательства (compliance). Важным аспектом остаётся слаженная кооперация Заявителя и инспектируемой площадки. Однако при грамотной организации и распределении ролей процесс будет проходить слаженно и гладко.
Удачных вам инспекций!
Ссылки на источник:
- (1) официальный сайт https://gilsinp.ru/
- (2) определения взяты из инспекционного отчёта, предоставленного ФБУ «ГИЛС и НП»
- (3) Приказ от 26 мая 2016 года N 1714 «Об утверждении административного регламента Министерства промышленности и торговли РФ по предоставлению государственной услуги по выдаче заключений о соответствии производителей лекарственных средств для медицинского применения требованиям правил надлежащей производственной практики»
* по результатам инспекции ФБУ «ГИЛС и НП» готовит инспекционный отчёт
Краткая справка по классификации несоответствий (2)
Критические — нарушения (несоответствия) требований Правил надлежащей производственной практики или требований регистрационного досье на лекарственное средство для медицинского применения, которые привели или могут привести к производству некачественного лекарственного средства для медицинского применения, которое причинило или может причинить вред здоровью или жизни человека.
Существенные — нарушения (несоответствия) требований Правил надлежащей производственной практики, которые привели или могут привести к производству некачественного лекарственного средства для медицинского применения, которое не может причинить вред здоровью или жизни человека, или нарушение (несоответствие) требований регистрационного досье на лекарственное средство для медицинского применения, или совокупность нескольких несущественных нарушений (несоответствий), ни одно из которых не может быть классифицировано как существенное, но которые в совокупности являются существенным нарушением (несоответствием) и должны толковаться как существенное нарушение (несоответствие).
Прочие — нарушения (несоответствия) требований Правил надлежащей производственной практики, которые не отнесены ни к критическим, ни к существенным нарушениям.
Источник: GDP REVIEW 3 — Сборник практических статей IV Международной конференции Логистика лекарственных средств 


