1. Введение

Директор по качеству
Ядерная медицина – актуальная и востребованная отрасль в России и мире. Радиофармацевтические лекарственные препараты (РФЛП) содержат в готовой для использования форме радионуклид (радиоактивный изотоп). РФЛП являются основой ядерной медицины и широко используются для диагностики и лечения различных заболеваний. Радиоизотопные методики отличаются высокой эффективностью, простотой выполнения и практически безопасны для здоровья человека (ОФС.1.11.0001.15 Радиофармацевтические лекарственные препараты).
От традиционных лекарственных средств радиофармацевтические препараты отличаются практически отсутствием фармакодинамического воздействия на организм человека, что обусловлено введением малых количеств меченого химического соединения. Лечебное действие РФЛП обусловлено не влиянием химического соединения, а излучением входящего в его структуру радионуклида.

Старший менеджер по
качеству
В основе диагностического использования РФЛП лежат особенности их фармакокинетики, что позволяет получать изображение органа и определять его анатомо-топографические характеристики либо оценивать функциональное состояние органа или системы, не нарушая физических условий его работы.
Важным параметром РФЛП является период полураспада (T ½) – это промежуток времени, в течение которого число радиоактивных ядер уменьшается вдвое. Величина периода полураспада для разных изотопов может изменяться в очень широких пределах. В соответствии с этим, радиоактивные изотопы можно разделить на группы:
- Долгоживущие, T½ > 10 суток,
- Короткоживущие, T½ < 10 суток,
- Ультракороткоживущие (УКЖ), T½ < 2 часов.
Период полураспада не является сроком годности препарата. Основной способ введения РФЛП — парентеральный (внутривенные инъекции). Основным компонентом любого РФЛП является радиоактивный изотоп, который можно произвести разными способами.
К объектам ядерной медицины предъявляются регуляторные требования как к производителям лекарственных средств, так и к объектам ядерной энергии. Производители РФЛП соблюдают требования GMP и радиационной безопасности (РБ).
Компании имеют разрешительные документы:

2. Нужно ли организации оптовой торговли ЛС, имеющей фармацевтическую лицензию, соответствующей требованиям GDP (Решение от 3 ноября 2016 года N 80 «Об утверждении Правил надлежащей дистрибьюторской практики ЕАЭС»), какие-либо дополнительные документы для того, чтобы заниматься дистрибьюцией и транспортировкой РФЛП?
Фармацевтическая деятельность регулируется Федеральной службой по надзору в сфере здравоохранения (Росздравнадзор). В национальных нормативных требованиях и Правилах хранения ЛС отсутствовали уточнения, связанные с хранением и транспортировкой РФЛП. Однако в Решении N 80 «Об утверждении Правил надлежащей дистрибьюторской практики ЕАЭС» от 3 ноября 2016 года присутствует несколько ссылок:
Руководством дистрибьютора должно быть назначено ответственное лицо. Ответственное лицо должно соответствовать квалификационным требованиям, установленным законодательством государства-члена, и обладать необходимой квалификацией (предпочтительно фармацевтическим образованием), опытом и знаниями в области надлежащей дистрибьюции. В отдельных случаях ответственное лицо может иметь нефармацевтическое образование, в том числе при дистрибьюции радиофармацевтических препаратов — образование в области радиобиологии, ядерной физики или радиофизики, при дистрибьюции медицинских газов — образование физико-технического профиля.
Радиофармацевтические и другие опасные лекарственные средства, а также огнеопасные и взрывоопасные лекарственные средства (например, медицинские газы, легковоспламеняющиеся жидкости и твёрдые вещества) должны храниться в специально отведённых зонах в соответствии с законодательством государств-членов с применением соответствующих мер безопасности и должны быть защищены от неправомерного доступа.
Опасные (высокоактивные) и радиоактивные лекарственные средства должны транспортироваться в защищённых, специализированных и надёжных транспортных средствах. Принимаемые меры безопасности должны соответствовать законодательству государств-членов и международным договорам.
Персонал, работающий с продукцией, в отношении которой установлены более жёсткие условия обращения, должен пройти специальную подготовку. Примерами такой продукции являются огнеопасные, взрывоопасные, легковоспламеняющиеся, легкогорючие, радиоактивные материалы, лекарственные средства, подлежащие особому контролю, в соответствии с законодательством государств-членов, термолабильные лекарственные средства.
Какие национальные требования необходимо выполнять? Требования регламентируются Федеральным законом от 9 января 1996 года N 3-ФЗ «О радиационной безопасности населения».
Под радиационной безопасностью населения подразумевается состояние защищённости настоящего и будущего поколений людей от вредного для их здоровья воздействия ионизирующего излучения, то есть излучения, которое создаётся при радиоактивном распаде, ядерных превращениях, торможении заряженных частиц в веществе и образует при взаимодействии со средой ионы разных знаков.

Можно назвать следующие особенности регулирования деятельности по обращению радиофармацевтических лекарственных средств:
- субъекты обращения этой категории лекарственных средств подлежат плановым и внеплановым проверкам со стороны органов федерального государственного надзора в области использования атомной энергии и федерального государственного санитарно-эпидемиологического надзора;
- указанные субъекты обязаны проводить производственный контроль за обеспечением радиационной безопасности.
На первичную упаковку и вторичную (потребительскую) упаковку радиофармацевтических лекарственных средств должен наноситься знак радиационной опасности (ФЗ №61 ст.46).
Особые требования предъявляются к хранению радиофармацевтических лекарственных средств, а также к их уничтожению. Хранение и уничтожение радиофармацевтических лекарственных средств осуществляется в соответствии с законодательством Российской Федерации (ФЗ №61 ст.58) (ФЗ №61 ст.59).
3. Обращение и эксплуатация радиоактивных веществ подлежат лицензированию
Обращение РФЛП регулируется Законодательством Российской Федерации в области обеспечения радиационной безопасности Федеральной службой по экологическому, технологическому и атомному надзору.
Для осуществления деятельности дистрибьюции РФЛП организация должна получить следующие лицензии:

С точки зрения РЗН, для транспортных компаний, осуществляющих только транспортировку ЛС, не требуется отдельной фармацевтической лицензии, они осуществляют свою деятельность под контролем лицензированных компаний (производителей или дистрибьюторов ЛС). Данное правило не действует с точки зрения требований радиационной безопасности. Любой компании, которая работает с источником ионизирующего излучения, требуется лицензия Ростехнадзора, в том числе и для транспортных компаний.
Существуют определённые сходства в подготовке к процедуре лицензирования для фармацевтической лицензии (ЛС) и лицензии на эксплуатацию радиационных источников (РФЛП).
1. Например, предъявляются определённые требования к ответственному персоналу.
Для подготовки к проверке Ростехнадзора сотрудники, заявленные при подаче пакета документов для получения лицензии, деятельность которых будет связана с эксплуатацией РФЛП, должны пройти внешнее обучение по дополнительной профессиональной программе повышения квалификации «Радиационная безопасность: концепция; нормы и правила; контроль».
Программа предусматривает повышение квалификации руководителей и специалистов, осуществляющих обеспечение радиационной безопасности, а также персонала группы, а в организациях, эксплуатирующих радиационные источники, и включает вопросы обеспечения радиационной безопасности, учёта, контроля, физической защиты радиоактивных веществ, радиоактивных отходов.
Повышение квалификации по данной Программе является одним из условий для последующего получения разрешений Ростехнадзора на право ведения работ в области использования атомной энергии и допуска персонала группы А к работе с источниками ионизирующего излучения.
По результатам обучения проводится экзамен и выдаётся удостоверение о повышении квалификации установленного образца.
С точки зрения фармдеятельности Приказом генерального директора должно быть назначено Ответственное лицо. Определены требования к его образованию.
2. Предъявляются требования к внутреннему обучению персонала по утверждённой программе.
3. Процессы должны быть регламентированы и описаны в процедурах/инструкциях, а ответственные лица назначены приказами.
В обоих случаях должен быть документ — Руководство по качеству. Соответственно, должна быть сформирована система качества. Выбор компании — разделять эти системы или формировать единую систему качества с общим подходом к документообороту, обучению и тд.
Проверки компании Росздравнадзором (РЗН) и Ростехнадзором похожи, но в то же время есть между ними есть существенные различия. В первую очередь, это объекты контроля. Если в случае GDP фокус сформирован на продукте — лекарственном препарате, то в случае радиационной безопасности – это человек, который работает с источником излучения, и общая безопасность населения. Поэтому вроде бы похожие вещи, например, медицинские осмотры, имеют разные аспекты.
Для получения разрешения на право ведения работ в области использования атомной энергии (ОИАЭ) сотрудник должен, помимо довольно строгого медицинского освидетельствования, которое направлено на проверку здоровья и возможность продолжать работать с радиацией, пройти психофизическую экспертизу в аккредитованном на данный вид деятельности медицинском центре.
В качестве меры контроля к лицензии Ростехнадзора прилагаются «Условия действия лицензии» (УДЛ), состоящие из большого количества пунктов, которые необходимо выполнять в указанные сроки и представлять в Ростехнадзор отчёты о работе и авариях в области использования атомной энергии (ОИАЭ). При получении лицензии на фармацевтическую деятельность таких требований нет.
4. Хранение и Транспортировка
В фармакопейной статье или нормативной документации указывают конкретные условия хранения препарата, обусловленные его специфическими свойствами и обеспечивающие сохранность его качества (температурный режим и т.д.). Радиофармацевтические лекарственные препараты должны тщательно закрываться и храниться в зоне, предназначенной для данных целей. Во время хранения материал первичной упаковки может менять окраску в результате облучения. Изменение окраски не означает ухудшения качества препарата. (ОФС.1.11.0001.15 Радиофармацевтические лекарственные препараты).
Все процедуры с РФЛП выполняются в соответствии с действующими нормативными документами, регламентирующими правила работы с радиоактивными веществами, включая их хранение и транспортировку.
РФЛП являются частным случаем других лекарственных препаратов, и на них распространяются общие требования, предъявляемые к другим ЛС, в том числе ОФС.1.1.0010.18. «Хранение лекарственных средств» и ОФС.1.1.0025.18 «Упаковка, маркировка и транспортирование лекарственных средств», в которых говорится о необходимости определения температурного режима.
По защите от факторов внешнего воздействия обычными считаются условия хранения в проветриваемом помещении при относительной влажности не более 65% в зависимости от соответствующей климатической зоны (I, II, III, IVА, IVБ), если специальные условия хранения не указаны в нормативной документации (ОФС.1.1.0010.18), и температуре 15-20°С или, в зависимости от климатической зоны, до 30°С, при исключении посторонних запахов, источников загрязнения и интенсивного освещения (ОФС.1.1.0025.18).
Работа с РФЛП должна осуществляться в соответствии с «Нормами радиационной безопасности» (НРБ-99/2009) и «Основными санитарными правилами обеспечения радиационной безопасности» (ОСПОРБ-99/10): там указаны условия хранения упаковки при температуре не выше 25°С.
В Европейской Академии лектор на семинарах обозначает необходимость соблюдения температуры при хранении и транспортировке РФЛП.

Если проанализировать англоязычные инструкции к применению радиофармацевтических препаратов, то можно увидеть, что режим хранения в них указан.
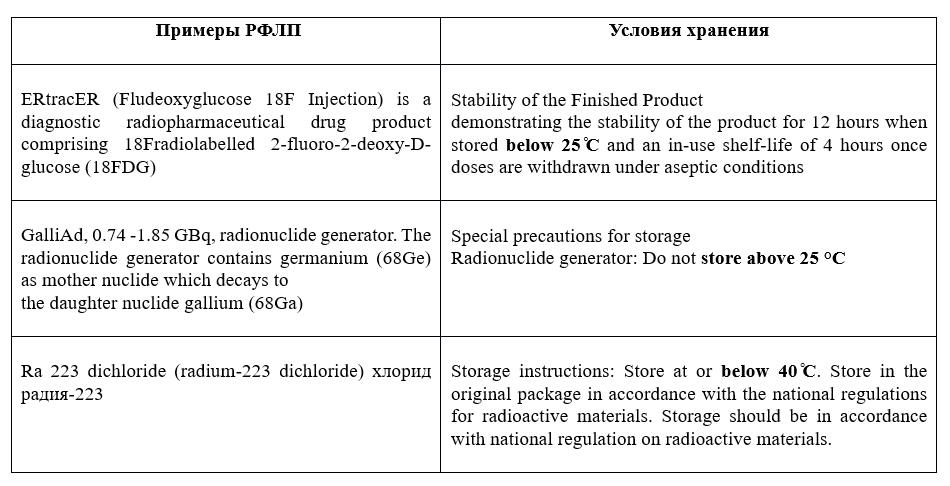
РФЛП не являются ЛС, чувствительными к температуре и влажности, но нельзя забывать указывать условия их хранения в регистрационных документах. Если зайти в реестр ЛС РФ на сайте https://grls.rosminzdrav.ru/, то в большинстве случаев в графе «условия хранения» указано: «В соответствии с основными санитарными правилами обеспечения радиационной безопасности (ОСПОРБ-99/2010) и Нормами радиационной безопасности (НРБ-99/2009)».
Отсутствие требований к температуре при хранении и транспортировке приводит к таким последствиям, как например, заморозка препарата:
«Вы, не могли бы объяснить, как нам получать генераторы 99 Мо 99 мТс незамороженными?»
«Вопрос полувековой Аэропорт наш хранит на улице генератор, а раствор генератора зимой замерзает, может и ампула треснуть! И никто не виноват!!» «Зимой груз поступает замороженным! И нужно полдня терять на его разморозку. И есть риск, что колонка от льда треснет!!»
«Мы зимой замучились уже. Больница наша областная люди едут за 200 км, а у нас генератор замороженный (или лопнул?)»
(письмо врача региональной областной больницы).
Условия хранения определяет производитель, отсутствие требований к температуре должно быть подтверждено результатами стабильности.
Упаковка РФЛП должна обеспечивать не только сохранность препарата, но и снижение мощности дозы излучения до допустимого уровня на поверхности.
Транспортирование РФЛП выполняется в соответствии с действующими правилами безопасности при транспортировании радиоактивных веществ. Упаковка и маркировка РФЛП должны производиться в соответствии с действующим законодательством РФ в этой области в отношении радиоактивных препаратов медицинского назначения.

Лицензия даёт право на обращение с радиоактивными веществами при их транспортировании, например, автомобильным видом транспорта.
Если в фармацевтической компании есть свой автопарк, но нет лицензии на обращение с радиоактивными веществами при их транспортировании, то необходимо заключать договор с организацией, имеющей такую лицензию.
Перевозка опасных грузов по территории России и в межгосударственном сообщении осуществляется согласно требованиям нормативных документов, главным из которых является ДОПОГ (Дорожная перевозка опасных грузов).
Понятие «опасный груз» означает перевозку потенциально опасных веществ, способных в случае дорожно-транспортного происшествия и их рассыпания или розлива нанести вред здоровью человека и создать экологически опасную обстановку на местности. В список опасных грузов ДОПОГ входит более трёх тысяч наименований различного рода веществ. Все они зарегистрированы в специальном реестре ООН и имеют свой идентификационный номер.
Регулирование деятельности по транспортировке осуществляет Федеральная служба по экологическому, технологическому и атомному надзору согласно приказу от 27 декабря 2011 года n. 747 об утверждении федеральных норм и правил в области использования атомной энергии «Правила физической защиты радиоактивных веществ и радиационных источников при их транспортировании» (НП-073-11).
Физическая защита радиоактивного вещества (РВ) и радиационного источника (РИ) должна осуществляться с момента выхода транспортных средств за территорию объекта грузоотправителя.
Физическая защита РВ и РИ при транспортировании должна осуществляться с учётом применяемых в соответствии с правилами безопасности при транспортировании мер и не создавать помех указанным мерам.
Для транспортирования РВ и РИ должна быть определена ответственная за их физическую защиту организация грузоотправителя, или грузополучателя, или перевозчика (далее — организация, ответственная за физическую защиту).
Целью обеспечения физической защиты РВ, РИ при транспортировании является предотвращение хищений РВ, РИ и диверсий в отношении РВ, РИ, которые могут привести к радиационному воздействию на людей и окружающую среду сверх установленных пределов.
Перевозчик осуществляет деятельность по перевозке грузов на основании лицензии на право обращения с радиоактивными веществами при их транспортировании. Заказчик осуществляет деятельность на основании лицензии на эксплуатацию радиационных источников.
Компания, согласно Решению № 80 ЕАЭС, должна осуществлять оценку поставщиков услуг и заключать с ними соглашение о качестве.
5. Особенности транспортировки РФЛП
- свинцовая защита,
- специальная маркировка (опасный груз),
- сертифицированная транспортная упаковка продукта,
- дозиметрический контроль,
- фиксация груза,
- сопровождающий и ответственный за груз,
- использование только специального автомобильного транспорта,
- бронирование транспорта (самолет+ автомобиль) до начала производства препарата,
- пациенты записываются на приём до производства препарата,
- в случае сбоя производства или доставки пациент не получает препарат вовремя,
- государство определило лимит активности для каждого вида транспорта, соответственно, возникает необходимость транспортировки небольших габаритов груза в разных транспортных средствах и невозможность его объединить,
- срок годности исчисляется в часах или максимум нескольких месяцах,
- на складах отсутствует запас продукции,
- необходимость лицензии Ростехнадзора всем участникам обращения, включая транспортировку.
Сотрудники перевозчика, занятые в организации процесса транспортировки и непосредственно в транспортировке товара, должны проходить первичное при приёме на работу и ежегодное повторное обучение, а также соответствовать следующим квалификационным требованиям:
- отсутствие отклонений по медицинским показаниям согласно Приказу Минздрава № 29Н от 28.01.2021;
- обучение основам радиационной безопасности (РБ);
- обучение по программе ДОПОГ (базовый курс перевозки опасных грузов + перевозка грузов 7 класса опасности);
- прохождение регулярных контраварийных тренировок;
- регулярная проверка знаний в области безопасного транспортирования грузов 7 класса опасности;
- предрейсовые инструктажи.
Сотрудники имеют разрешение Федеральной службы по экологическому, технологическому и атомному надзору на право ведения работ в области использования атомной энергии в соответствии с перечнем должностей работников объектов использования атомной энергии.
Каждый водитель-экспедитор должен иметь на рабочем месте памятку по особенностям транспортировки РФЛП.
Сотрудники Исполнителя при приёме на работу проходят проверку по факту наличия судимостей, учёта в наркологическом диспансере и отсутствия принадлежности к террористическим и экстремистским организациям.
Требования к обеспечению безопасности перевозок:
- Первичная упаковка, — это, как правило, стеклянный флакон.
- Вторичная упаковка — свинцовый контейнер.
Далее Радиофармацевтический препарат размещается в транспортную упаковку, имеющую Сертификат-разрешение на конструкцию упаковки типа A для транспортирования радиоактивных веществ.
Упаковка типа A — упаковочный комплект, содержащий радиоактивный материал с активностью, не превышающей указанных значений.

Сертификат выдаёт Росатом на каждое юридическое лицо, кто работает с этими упаковками.
Испытания проводит производитель упаковки.
Несколько примеров испытаний:
- упаковка должна выдержать диапазон температур от – 40 до +70 °С;
- час под дождём интенсивностью примерно 5 см/ч;
- пломба не должна поддаваться повреждению;
- испытание на свободное падение.

Перевозчик должен иметь и соблюдать требования следующих документов:
- Программа обеспечения качества при транспортировании РВ;
- Программа радиационной защиты персонала;
- Инструкция по радиационной безопасности при транспортировании;
- Инструкция по оказания первой неотложной медицинской помощи;
- Инструкция по действиям персонала в аварийных ситуациях;
- План работ по устранению возможных последствий аварий;
- Должностная инструкция;
- Определение модели нарушителя и анализ угроз для безопасности транспортирования;
- Аварийная карточка №701.
Ответственность перевозчика состоит в том, что перевозчик:

- применяет меры защиты для предотвращения повреждения товара (разливание, рассыпание, бой), попадания товара под действие чрезвычайных условий (например, жара, холод, свет, повышенная влажность), кражи товара и гарантирует защиту от загрязнений другой продукцией и вредителей (микроорганизмы, грызуны, животные);
- обеспечивает транспортировку товара с соблюдением требуемых условий хранения и транспортировки (автомобили должны быть надлежащим образом укомплектованы);
- проводит радиационный контроль при обращении с радиоактивными веществами который должен обеспечивать надёжное определение дозы облучения;

- осуществляет транспортировку товара согласно утверждённой процедуре транспортировки радиоактивных веществ и осуществления контроля безопасности транспортирования данных радиоактивных веществ;
- принимает все необходимые меры для предотвращения кражи товара; несёт ответственность за качество товара в процессе транспортировки до момента передачи грузополучателю.
6. Вывод:
Для РФПЛ необходимо соблюдать как требования, предъявляемые к производству/дистрибьюции ЛС, в том числе к контролю температурных режимов хранения и транспортировки, так и требования радиационной безопасности.
Производитель, имеющий лицензию GMP и Ростехнадзора, может поставлять РФЛП только дистрибьютору, имеющему лицензию Ростехнадзора и Росздравнадзора, перевозчик может поставлять РФЛП, имея соответствующую лицензию, только в клинику, у которой также есть лицензия на право ведения работ в области использования атомной энергии (ОИАЭ).
В случае с РФЛП высока цена ошибки. Производитель организовывает производственно-логистический процесс индивидуально для каждого пациента, для доставки РФЛП точно в срок в конкретную медицинскую организацию. Партия выпущена под конкретного пациента, направляется в медицинскую организацию, и очень важно соблюсти сроки доставки и сохранить качество РФЛП, т.к. от времени транспортировки зависит остаточный срок годности РФЛП и его эффективность. Транспортировка не должна превышать срок годности препарата.
7. Список используемой литературы
- Решение N 80 «Об утверждении Правил надлежащей дистрибьюторской практики ЕАЭС» от 3 ноября 2016 года.
- ФЗ № 61.
- Федеральный закон N 3-ФЗ «О радиационной безопасности населения» от 9 января 1996 года.
- ОФС.1.11.0001.15 «Радиофармацевтические лекарственные препараты».
- ОФС.1.1.0025.18 «Упаковка, маркировка и транспортирование лекарственных средств».
- ОФС.1.1.0010.18. «Хранение лекарственных средств».
- Административный регламент предоставления Федеральной службой по экологическому, технологическому и атомному надзору государственной услуги по лицензированию деятельности в области использования атомной энергии No 453, утверждённый Приказом Федеральной службы по экологическому, технологическому и атомному надзору от 08 октября 2014 года.
- ДОПОГ (Дорожная перевозка опасных грузов).
- НП-053-16 «Правила безопасности при транспортировании радиоактивных материалов».
- ОСПОРБ-99/2010 «Основные санитарные правила обеспечения радиационной безопасности».
- Приказ от 27 декабря 2011 года n. 747 об утверждении федеральных норм и правил в области использования атомной энергии «Правила физической защиты радиоактивных веществ и радиационных источников при их транспортировании» (НП-073-11).
- Приказ Минздрава № 29Н от 28.01.2021.
- «Радиофармацевтика – уникальное направление фармацевтической индустрии». Автор: Елена Зелинская, GMP- эксперт (материал опубликован в журнале «Новости GMP» №2 (16) лето 2018).
- «Нормативное регулирование радиофармацевтических лекарственных препаратов». Елена Валерьевна Зелинская, GMP- эксперт.
- «Перевозка радиофармацевтических препаратов». Елена Валерьевна Зелинская, GMP- эксперт.
- https://grls.rosminzdrav.ru/.
- Приказ Минздрава России от 28.01.2021 N 29н «Об утверждении Порядка проведения обязательных предварительных и периодических медицинских осмотров работников, предусмотренных частью четвёртой статьи 213 Трудового кодекса Российской Федерации, перечня медицинских противопоказаний к осуществлению работ с вредными и (или) опасными производственными факторами, а также работам, при выполнении которых проводятся обязательные предварительные и периодические медицинские осмотры».
Источник: GDP REVIEW 3 — Сборник практических статей IV Международной конференции Логистика лекарственных средств 


