Роль фармацевтической отрасли для здравоохранения очевидна и огромна. Лекарства – это основной инструмент врача. Яркие примеры снижения смертности и заболеваемости населения благодаря прорывам в разработке новых лекарств можно перечислять бесконечно.
Так, открытие в 1928 г. А. Флемингом пенициллина и внедрение его в лечебную практику во время Второй мировой войны [1], привело не только к значительному снижению смертности от инфекционных заболеваний во всем мире, но и значительному прогрессу в хирургии. В Великобритании с 1981 по 2000 г. смертность от болезней системы кровообращения снизилась в 2 раза, и более половины медицинского эффекта произошло благодаря новым лекарствам [2]. Появившееся в последнее время «препараты прямого противовирусного действия» [3] против гепатита С позволяют полностью вылечить это тяжелое заболевание. Антиретровирусная терапия превратила ВИЧ-инфекцию из неизбежно смертельного заболевания в управляемое хроническое, причем схемы лечения стали максимально удобными для пациентов, соответственно возросла приверженность пациентов к терапии. Лекарственные препараты (ЛП) — ингибиторы тирозин-киназы позволили увеличить с 20% до 90% 5-летнюю выживаемость пациентов с хронической миелоидной лейкемией [4]. ЛП клеточной и генной терапии, зарегистрированные в последние годы, могут обеспечить новый принципиальный прорыв в области снижения заболеваемости и смертности населения.
Но роль фармацевтической отрасли не ограничивается системой здравоохранения, она играет важнейшую роль в развитии мировой экономики и экономики отдельных стран.
В 2018 г. общий объем продаж ЛС составил $1,2 трлн в конечных ценах потребителей [5]. Это 1,4% мирового ВВП в 2018 г. В развитых странах продажи ЛС составляют в среднем 1,7% ВВП (амбулаторный и стационарный сектор) [6]. Фармацевтическая отрасль играет также большую роль в занятости населения: всего в мире в фармацевтической отрасли занято около 4,4 млн чел. [7]. Некоторые развитые страны (например, Германия) получают значительную дополнительную выручку от экспорта ЛС — $92 млрд в 2018 г. или 6,2% от общего экспорта страны [8].
Большинство научных исследований в области наук о человеке – это поиск новых молекул и разработка новых лекарств. Фармацевтические компании также помогают развивать науку и образование, например, в 2018 г. вложения в научные исследования составили $150 млрд (или 12,5% от общих продаж на фармацевтическом рынке) [9].
В Советском Союзе фармацевтическая отрасль была хорошо развита. К 1990 г. по масштабам производства лекарств, численности аптечной сети, кадровым ресурсам и объему продаж она являлась одной из крупнейших в мире. К 1986 г. количество аптечных учреждений составляло 31,3 тыс. организаций, количество занятых в фармацевтике – более 20 тыс. чел. [10]. Затем, после распада Советского Союза, в период с 1993 по 2012 г. в результате снижения государственного финансирования медицинской науки и фармацевтического производства, сокращения общего объема государственных закупок ЛП, а также перехода преимущественно на потребление импортных ЛС, вес и роль отечественный фармацевтического сектора существенно ослабла.
В этой связи в 2009 г. были приняты Стратегия и Программа развития отечественной фармацевтической промышленности [11]. Благодаря реализации этой Программы были достигнуты следующие результаты: доля отечественных ЛП выросла до 30% от общего объема рынка, доля российских препаратов в перечне ЖНВЛП (Жизненно необходимые и важнейшие лекарственные препараты) составляет более 86%, объем экспорта в 2018 г. превысил $500 млн [12].
Сегодня, согласно Указу Президента РФ от 7 мая 2018 г. «О национальных целях и стратегических задачах РФ» предстоит сделать следующий прорыв в области развития социальной сферы и экономики страны, в том числе отечественной фармацевтической отрасли [13].
В Указе поставлены следующие цели:
- Увеличить ожидаемую продолжительность жизни (ОПЖ) населения с 72,9 лет в 2018 г. до 78 лет к 2024 г. и, далее, до 80 лет к 2030 г.
- Ускорить технологическое развитие РФ, в том числе увеличить число организаций, осуществляющих технологические инновации до 50% от общего числа организаций.
- Обеспечить экономический рост страны больше общемирового при сохранении макроэкономической стабильности, а также обеспечить вхождение РФ в 5 крупнейших экономик мира к 2024 г.
- Создать экспортоориентированный сектор, в том числе в агропромышленном секторе и секторе медицинских услуг.
В достижении этих целей фармацевтическая отрасль должна сыграть не последнюю роль. Именно поэтому действующая Программа «Фарма-2020» была продлена до 2024 г. Согласно программе, к 2024 г. необходимо достичь следующих показателей:
- увеличить число рабочих мест до 23 тыс.;
- увеличить долю ЛП отечественного производства до 36,4% в общем объеме продаж;
- увеличить до 80 процентов долю стратегически значимых ЛС, производство которых осуществляется по полному производственному циклу на территории РФ [14].
В этой связи важно изучить опыт развитых стран в области инновационного развития фармацевтической отрасли. В этой статье мы сравнили РФ по ключевым показателям, характеризующим состояние фармацевтической отрасли, с другими странами; изучили наиболее распространенные меры государственной политики, направленные на стимулирование ее развития, а также отдельные программы, реализующиеся сегодня в США, ЕС (Великобритании), Южной Корее и Китае. На основании анализа сделаны рекомендации для РФ по формированию национальной лекарственной политики, которая будет способствовать достижению национальных целей страны.
Сравнение показателей развития фармацевтической отрасли в РФ и других странах
В таблице 1 представлено сравнение ключевых показателей, характеризующих состояние и деятельность фармацевтической отрасли в РФ и развитых странах (США, Великобритания, Южная Корея, Китай). Красным цветом показаны те показатели в РФ, которые отстают от названных стран.
Таблица 1. Сравнение показателей развития фармацевтической отрасли в РФ, США, Великобритании, Китае и Южной Корее
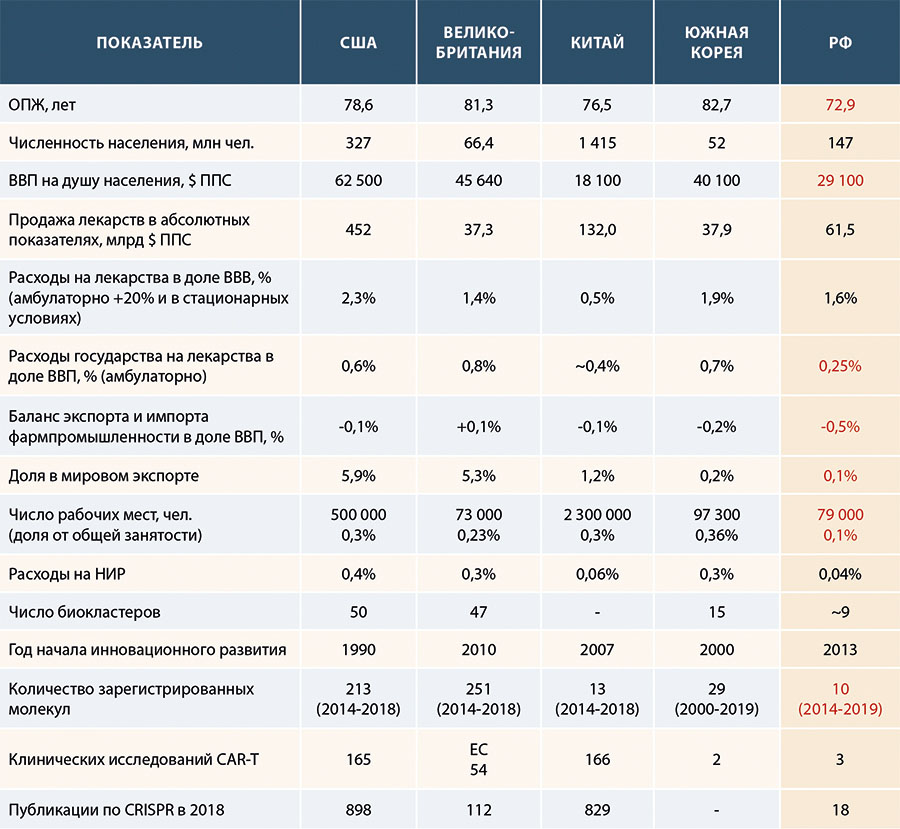
В РФ ОПЖ в 2018 г. составила 72,9 лет, что на 5,7 лет ниже, чем в США; на 8,4 лет ниже, чем в Великобритании; на 3,6 лет ниже, чем в Китае и на 9,8 лет ниже, чем в Южной Корее [15].
В РФ в 2018 г. ВВП на душу населения составил $29 100 ППС (ППС – паритет покупательной способности, в 2018 г. $1 ППС = 25,6 руб.), что на 61% выше, чем в Китае ($18,1 тыс. ППС); но на 53% ниже, чем в США (62 500 $ ППС); на 36% ниже, чем в Великобритании ($45 640 ППС) и на 27% ниже, чем в Южной Корее ($40 100 ППС).
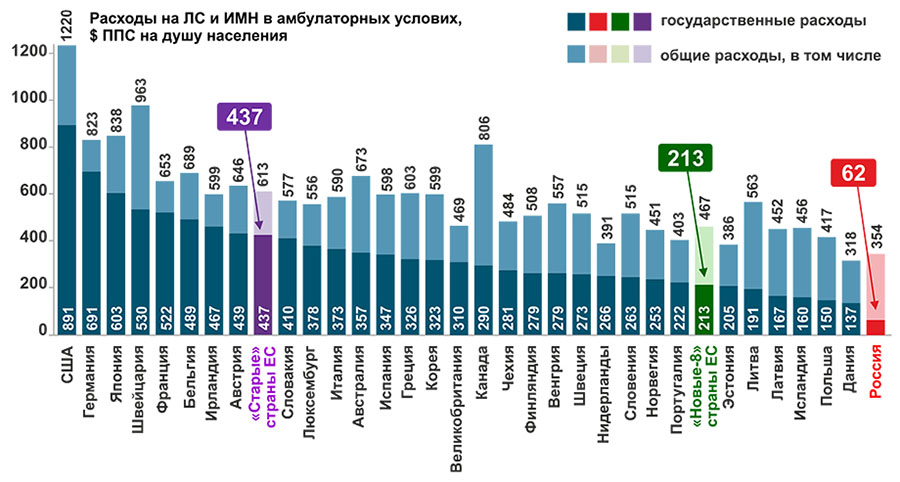
В РФ в 2018 г. объем фармацевтического рынка в абсолютных показателях составил $61,5 млрд ППС [5], что в 7,3 раза меньше¸ чем в США, в 2,1 раза меньше, чем в Китае, однако в 1,6 раза больше, чем в Великобритании и Южной Корее. Однако, в РФ в 2018 г. в доле ВВП расходы на лекарства составили только 1,6%, что значительно ниже, чем в большинстве рассматриваемых стран, кроме Китая (0,5% ВВП). В США этот показатель составляет 2,3% ВВП, в Великобритании 1,4%, в Южной Корее 1,9%. [15]. Также в РФ доля государственных затрат на ЛС в амбулаторных условиях составляет только 0,25% ВВП, что значительно ниже, чем в большинстве стран, в США они составляют 0,6% ВВП, в Великобритании – 0,8% ВВП, в Южной Корее – 0,7%, в Китае – 0,4%. Затраты на ЛС в амбулаторных условиях в $ ППС на душу населения в РФ также значительно ниже, чем в рассматриваемых странах ($62 ППС), что в 3,4 раза ниже, чем в «новых-8» странах ЕС, близких к РФ по уровню экономического развития (рис. 1).
Рисунок 1. Подушевые расходы на ЛП в амбулаторных условиях, в том числе оплачиваемые из государственных источников, в РФ и странах ЕС
В РФ фармацевтический рынок преимущественно импортоориентированный, в отличие от рынка, например, Великобритании. Это означает, что в РФ торговое сальдо экспорта и импорта отрицательное и составляет -0,5% ВВП, а Великобритании – +0,1% ВВП. РФ занимает небольшую долю в мировом фармацевтическом экспорте – только 0,1%, в то время как доля США в 59 раз выше и составляет 5,9% [16], а доля Германии в 168 раз выше – 16,8%.
Самая большая абсолютная занятость в фармотрасли – в Китае (2,3 млн чел.) или 0,3% от общего числа занятых [17], следующей страной по занятости в фармотрасли является США с количеством занятых 500 тыс. чел. или 0,3% от общего числа занятых [17]. В РФ в 2018 г. количество занятых в фармотрасли составило 79 тыс. чел. или 0,1% от всего работающего населения страны [18], это самый низкий показатель из рассматриваемых стран.
Самими важными показателями в оценке разработки новых ЛС являются затраты государства на НИР и количество новых зарегистрированных ЛС. В РФ расходы на НИР составили 0,04% ВВП, что в 10 раз ниже, чем в США (0,4% ВВП), в 7,5 раз ниже, чем в Великобритании (0,3% ВВП), и в 1,5 раз ниже, чем в Китае (0,06% ВВП) [15].
В последние пять лет увеличивается количество новых зарегистрированных ЛС. В РФ в период с 2014 по 2018 г. было зарегистрировано только 3 новых ЛС, в США за этот же период — 213 новых ЛС [19]. Рекордным для США стал 2018 г., когда в Администрации по Лекарствам и Пищевым продуктам (FDA — Food and Drug Administration) [19] было зарегистрировало 59 новых ЛС. Также большое количество новых препаратов регистрируется в Европе — 251 препарат за последние 5 лет [20].
В последние десятилетия постоянно повышается количество новых исследований в разработке ЛС. На настоящий момент в работе находится более 25 000 проектов (лекарственных препаратов-кандидатов, изучаемых по определенным показаниям) для 17 000 препаратов-кандидатов. Из них в клинической стадии исследований находятся 9 000 проектов [21]. То есть в ближайшие годы следует ожидать появления на рынке большого количества новых ЛС.
В том числе ЛС нового класса или так называемой передовой терапии. К ним относятся препараты клеточной терапии (например, CAR-T), ДНК и РНК препараты (генная терапия) и ткане-инженерные препараты [22]. Сегодня в мире в разработке находится более 800 CAR-T проектов, причем лидерами в этом направлении являются США (165 проектов в разработке) и Китай (166 проектов) [23]. Среди генных технологий одним из перспективных методик является CRISPR-технология, и половина всех публикаций по CRISPR-исследованиям имеют авторство ученых также из США (898 публикаций) и Китая (829 публикаций за 2018 г.). Для сравнения – учеными из РФ было опубликовано всего 18 статей по этому научному направлению [24].
Таким образом, из анализа ключевых показателей, характеризующих фармацевтическую отрасль, видно, что РФ существенно отстает от других стран по ОПЖ, по доле государственных расходов на лекарства в ВВП и на душу населения (в том числе в амбулаторных условиях), по числу рабочих мест в фармацевтической отрасли, по доле расходов на НИР в ВВП, по показателям инновационного развития отрасли.
Государственная политика развитых стран по ускорению разработки и выводу на рынок новых ЛС
Общие направления государственной политики
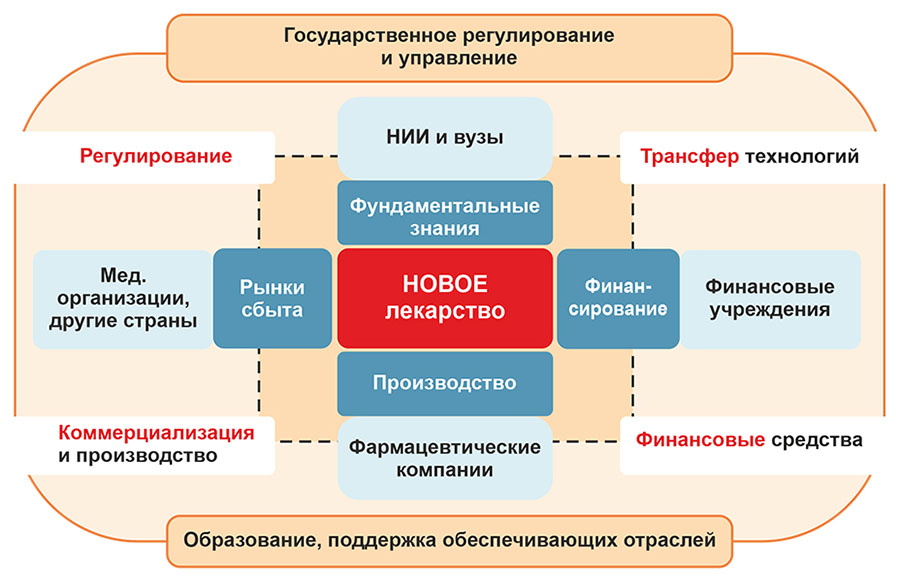
Четыре главных направления государственной политики по разработке новых ЛС представлены на рис. 2. Первое – стимулирование проведения научных исследований, второе – поддержка трансляции этих исследований в производство, третье – обеспечение ускоренной регистрации новых ЛС, и, четвертое, — расширение рынков сбыта (внутренних и потенцирование экспорта). Важную роль играют такие вспомогательные и поддерживающие инструменты, как развитие системы патентования, кадрового и материально-технического обеспечения фармацевтической отрасли.
Рисунок 2. Государственное регулирование и управление системой разработки новых ЛС
Открытие и разработка новых ЛС, трансляция НИР в коммерческий продукт
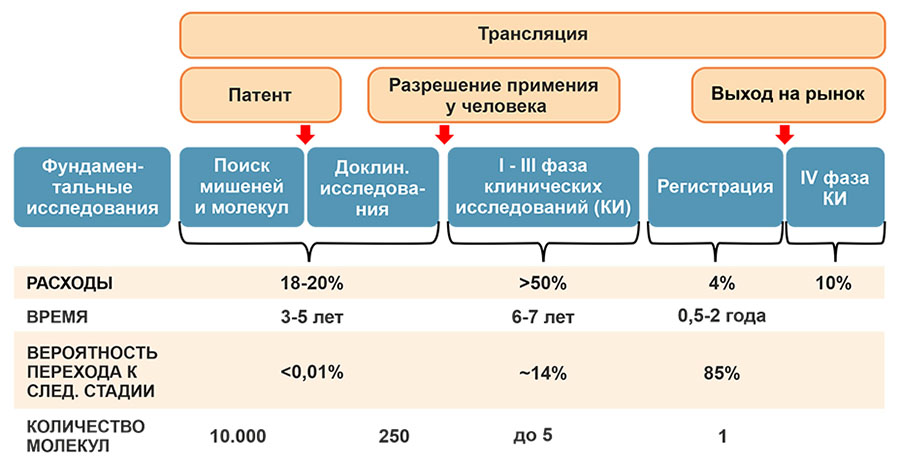
На рис. 3 представлены основные стадии открытия и разработки нового ЛС. Как правило, для этого требуется около 10-12 лет, из них поиск мишеней и молекул и доклинические исследования препарата занимают 3-5 года, клинические исследования – до 7 лет, регистрация ЛП проходит в течение 6 мес.-2 лет [25]. Из 10 000 молекул-кандидатов до регистрации доходит только одно ЛС.
Стоимость разработки одного ЛС постоянно повышается и, в настоящее время, составляет в среднем около $2 млрд [26]. Наиболее дорогостоящая стадия разработки – это клинические исследования, стоимость которых может составлять до 50% от всей стоимости разработки.
Рисунок 3. Стадии открытия и разработки нового ЛС
Государство активно поддерживают НИР в области открытия ЛС путем прямого финансирования разработок [27], особенно фундаментальных исследований. Это поддержка может быть в виде грантов университетам и фармацевтическим производителям, спонсирование работы научных институтов, заказ государством низко-маржинальных разработок (например, НИР по препаратам для лечения тропических заболеваний) [28]. Одним из инструментов стимулирования являются специальные налоговые льготы при проведении НИР.
Принято разделять эту политику на 2 типа “pull” — «вытягивание» и “push” — «подталкивание» [29].
«Вытягивание НИР» заключается в мерах, направленных на увеличение доходов частных компаний, занимающихся разработкой лекарств, это:
- создание благоприятной среды для патентования результатов интеллектуальной собственности (РИД);
- установление премиальных цен при закупках новых ЛП, «приз» за инновации»;
- ускоренная регистрация новых ЛП.
«Подталкивание НИР» направлено на снижение стоимости НИР, это, как правило:
- налоговые льготы при проведении НИР;
- прямое финансирование фундаментальных исследований – гранты;
- контракты длительного цикла, когда государство «заказывает» разработку ЛС фармацевтической компании с сохранением прав государства или с разделением их с разработчиком;
- прямое спонсорство всех циклов разработки, особенно для ЛС, направленных на неудовлетворенные нужды медицины, которые коммерчески невыгодны частным компаниям, например, создание новых антибиотиков, вакцин и др.
Трансляция НИР в коммерческий продукт является «узким горлышком» процесса разработки нового ЛС, то есть этапом, на котором многие проекты терпят неудачу [30]. Меры, которые позволяют преодолеть эту проблему:
- создание специальных условий патентования (например, акт Бея-Доула в США, см. далее);
- создание биокластеров, которые позволяют сосредоточить в одном месте ученых, разработчиков и производителей, например, Стевенджский центр в Великобритании (Stevenage Bioscience Catalyst);
- развитие государственно-частного партнерства (ГЧП), когда государство наряду с частными компаниями вкладывает средства в разработку новых лекарств, например, Инициатива по Инновационным Лекарствам (Innovative Medicine Initiative в ЕС);
- создание благоприятных условий для венчурного финансирования (развитие предпринимательства ученых, льготные кредиты и специальные венчурные фонды в США).
Для ускорения внедрения ЛС в производство государство организует государственные опытные производства для отработки промышленной технологии, предоставляет субсидии на перевооружение производств и трансфер зарубежных технологий.
Регистрация ЛС
Фармацевтическая отрасль требует строгого контроля со стороны государства в части эффективности, безопасности препаратов, контроля процессов доклинической и клинической разработки. Это международные требования к разработке «Надлежащая Лабораторная Практика», «Надлежащая Клиническая Практика» (GLP – Good Laboratory Practice, GCP-Good Clinical Practice) и контроля производственных процессов «Надлежащая Производственная Практика» (GMP- Good Manufacturing Practice). В последние годы, с развитием клеточных и тканевых технологий, появилась система контроля тканевых производств «Надлежащая Тканевая Практика» (GTP- Good Tissue Practice). Одновременно со строгим контролем, государство выработало меры по стимуляции разработки новых ЛС с помощью определенных регистрационных мер, это ускоренная регистрация, экспертная поддержка регистрационного процесса, например, в ЕС создана специальная Комиссия «Приоритетные препараты» (PRIME – Priority Medicines) для регистрации препаратов передовой терапии.
Государственные закупки ЛС
В силу высоких рисков и стоимости разработки лекарств, многие новые ЛС стоят крайне дорого. Например, препарат генной терапии спинальной мышечной атрофии Zolgensma стоит $2 млн на одного больного на курс лечения [30].
Для того, чтобы обеспечить баланс между применением новых ЛП, и дженериков (воспроизведенных) ЛП в развитых странах созданы специальные организации по оценке технологий в здравоохранении (Health Technology Advisory Committee). Задача этих организаций путем проведения сравнительной экономической и клинической эффективности оценить ценность нового ЛП для общества.
В большинстве стран ЕС для целей возмещения стоимости ЛП пациентам приняты позитивные перечни ЛП. В Германии, Великобритании и Испании используются негативные перечни (стоимость ЛП в них не возмещается государством). Доля ЛП, стоимость которых возмещается государством, составляет от 70% до 83% из всех зарегистрированных ЛП, из них ЛП с ограничениями по показаниям – от 40% до 60%. В Германии и Великобритании стоимость ЛП возмещается государством сразу после их регистрации (по цене, установленной производителем), пока не проведена оценка их клинической и экономической эффективности, не принято решение о включении их в возмещаемые перечни и не установлена цена возмещения. Процесс включения ЛП в перечень напрямую связан с установлением предельной цены на него.
Как правило, при принятии решения о включении ЛП в возмещаемый государством Перечень лекарств, оценивается дополнительный терапевтический эффект ЛП по сравнению с другими ЛП, его экономическая эффективность и влияние на бюджет здравоохранения (последнее – не все страны). Существует 2 основных подхода в оценке ЛП, которые зависят от того, установлена ли предварительная цена на ЛП:
- при наличии цены (установленной производителем или в процессе переговоров с ними) проводится оценка сравнительной экономической эффективности;
- оценка дополнительной терапевтической пользы от ЛП в сравнении с существующим на рынке ЛП, далее в зависимости от величины этого эффекта принимается решение о включении в перечень и цене возмещения.
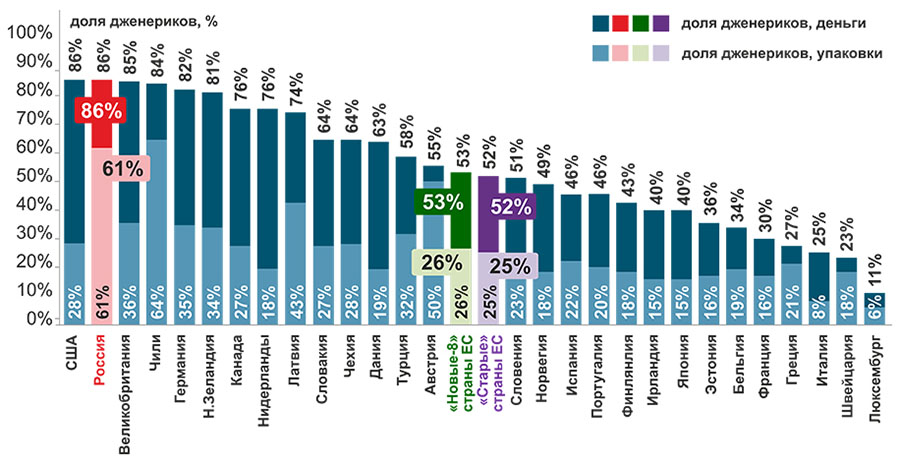
Следует отметить, что в РФ доля потребления воспроизведенных ЛП (дженериков) в РФ самая высокая среди стран ОЭСР, рис. 4. В 2018 г. в стоимостном выражении она составила 61%, что в 2,3 раза выше, чем в странах ЕС (в среднем у них 26%), и в упаковках – 86%, что в 1,6 раза выше, чем у них (53%). Это может свидетельствовать о том, что наши граждане недополучают сегодня инновационные лекарства [15, 32].
Рисунок 4. Доля дженериков на фармацевтическом рынке в РФ (2018) и странах ОЭСР (2017)
Для успешной разработки инновационных ЛС принципиально важна подготовка высококвалифицированных кадров. Для этого за счет государственных средств разрабатываются и реализуются в вузах и научных центрах специальные программы обучения и подготовки исследователей, в том числе и за рамками биолого-медицинских дисциплин, например, финансовый менеджмент, управление персоналом, медицинская и био-информатика. Разработка новых ЛС требует также развития обеспечивающих отраслей – химической, производства лабораторного оборудования, реактивов, лабораторное животноводство. Для ускорения исследований важно, чтобы все материально-техническое обеспечение было высокого качества и поставлялось в кратчайшие сроки.
Примеры инновационного развития фармацевтической отрасли в развитых странах
США
США по праву считается страной – лидером в разработке фармацевтических препаратов, в настоящее время около 60% всех научных исследований приходится на США.
Поддержка фундаментальных и клинических исследований. Комплексная поддержка государством научных разработок началась в 1945 г. с доклада Ванневара Буша перед президентом США «Наука без границ» («Science: the Endless Frontier») [33]. Вместо создания с нуля сети специализированных научно-исследовательских институтов под крышей одной или нескольких академий, Буш рекомендовал сформировать единую систему, основанную на партнерстве уже имеющихся университетов и федерального правительства. В результате в США был создан Национальный Институт Здоровья (NIH — National Institute of Health). Его целью стала организация и координация фундаментальных и прикладных исследований в биологии и медицине. На настоящий момент NIH является крупнейшим исследовательским учреждением в области здравоохранения в мире, его бюджет в 2019 г. составил $31млрд (в рублях по курсу ППС — 775 млрд рублей в год) [34]. Он объединяет 27 отдельных научных институтов по различным областям медицинских знаний. В 2011 г. в рамках NIH был создан отдельный центр для стимуляции процесса трансляции научных разработок — National Center of Advancing Translational Sciences [35]. А в 2011 г. был создан центр для анализа портфеля грантов, результатов исследований и прогнозирования финансирования исследований Office of Portfolio Analysis [36].
Ускорение трансляции НИР в коммерческий продукт. Важной ролью в создании системы трансляции научных разработок в коммерческий продукт стало принятие в США акта Бея-Доула или Акта по патентам и торговым маркам (Patent and Trademark Law Amendments Act) [37]. До принятия этого закона федеральное правительство владело правами на любое «патентабельное» научное исследование, которое было осуществлено на федеральные деньги. Акт Бея-Доула передал федеральные права на патенты и открытия самим университетам, оставив за последними право решать по своему усмотрению, как распоряжаться этими правами. В настоящее время в каждом университете США есть специальный отдел по патентованию.
В США с конца 70-х годов XX века начинает формироваться система венчурного финансирования фармацевтических разработок и производств. Примером ускоренной трансляции новейших научных разработок может служить CRISPR технология редактирования генома. Данное научное открытие было сделано в 1995 г. Francisco J.M. Mojica и описано как система иммунитета у бактерий [38]. В 2012 г. с интервалом в несколько месяцев появились работы Jennifer A. Doudna из Калифорнийского университета в Беркли [39] и Feng Zhang из Института Броуда MIT [40], в которых исследовалась возможность целенаправленного изменения генома с помощью метода CRISPR. Уже через два года после этих публикаций Jennifer A. Doudna основала малую биотехнологическую компанию Caribou Biosciences [41], а Feng Zhang стал президентом компании Editas Medicine [42]. В настоящее время обе компании, благодаря патентам и поддержке со стороны венчурных фондов, уже проводят доклинические и клинические исследования с использованием методики CRISPR.
Ускоренная регистрация новых ЛП. США также активно применяют ускоренную регистрацию лекарств. Этим занимается FDA с бюджетом $5,7 млрд в год и 15 тыс. сотрудников [43]. В настоящее время, механизмы ускоренной регистрации предусмотрены для следующих видов разработок: первый в классе, орфанный препарат, регистрация вне очереди, прорывная терапия, приоритетная регистрация, ускоренная регистрация (first in class, orphan designation, fast track, breakthrough, priority, accelerated approval) [19]. В результате в США в 2018 г. не менее 70% из 59 новых ЛП были зарегистрированы по укоренным процедурам. Специально для стимуляции регистрации клеточных и генных продуктов была установлена отдельная процедура регистрации этих препаратов (Regenerative Medicine Advanced Therapy Designation) [44].
Объем потребления ЛП. Большой объем фармацевтического рынка США и его постоянный рост создают благоприятные условия для коммерческого успеха новых ЛП. Клиническая и экономическая значимость новых препаратов оценивается в «Институт клинического и экономического рецензирования» Institute for Clinical and Economic Review [45]. Однако, следует отметить, что в США регулирование цен на ЛП в отличие от стран ЕС, менее строгое.
Страны ЕС
С 90-х годов ЕС уступает США в эффективности открытия и разработки новых фармацевтических препаратов по следующим причинам [46]:
- фрагментированность управления, финансирования и координации кадров и институтов, вовлеченных в этот процесс;
- недостаточное финансирование научных исследований в ряде стран, например, в Германии оно составляло 0,2% ВВП (€6,9 млрд), что в 2 раза ниже, чем в США – 0,4% ВВП ($82 млрд);
- слабо развитые инструменты венчурного финансирования и стимуляции развития малых биотехнологических компаний;
- недостаточность поощрения предпринимательства ученых;
- низкий уровень взаимодействия между отдельными участниками фармацевтической отрасли.
В связи с этим, на уровне ЕС и отдельных стран предпринимаются меры по преодолению названых проблем. Так, Европарламентом в 2008 г. была инициирована программа государственно-частного партнерства в фармацевтике “Инициатива по Инновационным Лекарствам” («Innovative Medicine Initiative»). В качестве показателей успеха программы к 2020 г. должно быть открыто не менее 50 новых таргетов для ЛС, молекул-кандидатов, биомаркеров и диагностических методик. Планируется привлечь не менее €300 млн частных инвестиций [47].
Важным инструментом стимуляции фармацевтических разработок в странах ЕС является создание биокластеров. В настоящее время в Европе существуют 180 биокластеров [48]. Примером является Stevenage Bioscience Catalyst центр, построенный при участии компании GSK, государства и других частных инвесторов. В нем создана инфраструктура и благоприятная среда для сотрудничества государственных учреждений, малых биотехнологических компаний, разработчиков новых диагностических агентов и программного обеспечения, а также центры коллективного пользования. В центре можно пройти обучение и повышение квалификации в области биологических и медицинских исследований. В биокластере также действует центр опытного производства препаратов передовой клеточной и генной терапии «Cell and Gene Therapy Catapult» [49].
Южная Корея
Южная Корея в 2000 г. приняла государственную программу инноваций в фармацевтической отрасли 2020 [51,52,53,54,55,56]. К тому времени эта страна уже имела опыт успешного внедрения инноваций в других высокотехнологичных областях: электронике, телекоммуникациях и автомобилестроении. Цели Программы до 2020 г.
- Войти в состав 7 стран – крупнейших производителей ЛП в мире.
- Увеличить экспорт ЛС в 10 раз с 2,3 трлн до 23 трлн KRW воны Республики Южная Корея.
- 2-м корейским фармацевтическим производителям попасть в 50-топ лист мировых фармацевтических производителей.
Приоритеты программы инновационного развития в Южной Корее:
- «Glocalization» то есть “localisation”–“globalization”. Это означает, что сначала происходит этап локализации производства дженериков, а затем – развитие производства биосимиляров и разработка новых препаратов для коммерциализации за рубежом.
- «Гармонизация»: полная гармонизация процессов разработки, производства и регистрации с международными требованиями, в том числе приглашение инспекторов FDA.
- «Развитие клинических исследований»: Сеул к 2016 г. стал городом №1 в Азии по количеству клинических исследований.
- «Исследования в области перспективных направлений науки»: развитие разработок клеточной и генной терапии, в результате в 2012 г. был зарегистрирован первый в мире препарат стволовых клеток Hearticellgram-AMI (Pharmicell).
- «Привлечение государственного и частного капитала», в том числе не-фармацевтических предприятий, например, такая компания как Samsung инвестировала до $700 млн в биотехнологический бизнес.
- «Привлечение человеческого капитала»: из-за рубежа было привлечено более 500 квалифицированных специалистов.
В результате реализации этой программы к 2018 г. в Южной Корее зарегистрировано 29 новых препаратов и 82 «значительно измененные препараты» («incrementally modified drugs»), постоянно растет экспорт, первые южнокорейские биосимиляры зарегистрированы в FDA и в ЕС.
Китай
Китай приступил к реализации государственной программы инновационного развития фармотрасли с 2007 г. по 2020 г. [57,58,59,60].
Цели программы:
- Внедрить международные стандарты фармацевтического производства;
- Обеспечить приоритетное развитие биотехнологического направления;
- Запустить в производство 20-30 новых лекарств;
- 5-10 из новых лекарств зарегистрировать в FDA или в ЕС.
К 2018 г. в этом направлении реализуется следующая политика:
- Государством активно поддерживаются научные исследования. В результате на разных этапах НИР находится 800 инновационных молекул и произошел существенный рост научных публикаций и патентов по передовым научным технологиям, например, CAR-T и CRISPR.
- Осуществляется выход на венчурные рынки США с целью обеспечения доступа к инновационным технологиям в разработке новых ЛС.
- Осуществляется централизация и анализ больших данных – информация о 10 млн пациентов сегодня собрана в единую базу данных.
- Привлекаются кадры из-за рубежа по программе «1000 Talents Program». По этой программе из-за рубежа ежегодно в Китай приезжают десятки тысяч китайцев, в том числе известные ученые.
- Привлекаются иностранные компании — к 2018 г. 20 глобальных фармпроизводителей открыли производственные и научные центры в Китае.
- Происходит централизация китайской фармпромышленности и переход производителей на требования GMP.
- Ограничивается доступ иностранных производителей к продажам на внутреннем рынке, соответственно, их вынуждают к локализации производства в Китае. Также государство снижает цены закупки ЛП, при этом субсидируя отечественные компании средствами на развитие производства.
Рекомендации для РФ по ускорению инновационного развития фармацевтической отрасли
На основании проведенного анализа в целях ускорения инновационного развития фармацевтической отрасли в РФ необходимо:
- Разработать, утвердить и реализовать Национальную лекарственную политику до 2030 г., направленную на инновационное развитие отрасли, включая мощный компонент фундаментальных исследований с конкретными целями.
- Предусмотреть создание единого центра управления этой политикой, который бы объединял действия различных министерств и ведомств в этом направлении.
- Увеличить объем внутреннего рынка сбыта ЛС как минимум в 2,4 раза или на 320 млрд руб. ежегодно в ценах 2018 г. (то есть до уровня близкого к «новым-8» странам ЕС по доле ВВП) [61, стр. 202].
- Увеличить объем инвестиций в НИР и НИОКР (после разработки национальной лекарственной политики) – в 3 раза или на 150 млрд руб. ежегодно (из них ½- государство, так как это происходит сегодня в развитых странах).
- Усилить инструменты привлечения частных инвесторов в НИР, путем развития венчурного финансирования и системы патентования результатов НИР.
Авторы материала:
Улумбекова Гузель Эрнстовна, доктор медицинских наук,
руководитель Высшей школы организации и управления здравоохранением (ВШОУЗ)
Худова Ирина Юрьевна, кандидат медицинских наук,
ведущий аналитик Высшей школы организации и управления здравоохранением (ВШОУЗ)
Материал опубликован в журнале «CIS GMP news» №1 (8) Winter 2020, Arabic Issue
Список литературы
- Penicillin: An accidental discovery changed the course of medicine Penicillin was first discovered in 1928 and is now the most widely used antibiotic in the world. https://www.healio.com/endocrinology/news/print/endocrine-today/%7B15afd2a1-2084-4ca6-a4e6-7185f5c4cfb0%7D/penicillin-an-accidental-discovery-changed-the-course-of-medicine (дата обращения 20.01.2020)
- Unal В., Critchley J.A., Capewell S. Explaining the Decline in Coronary Heart Disease Mortality in England and Wales Between 1981 and 2000. 2004;109:1101-1107.) DOI: 10.1161/01.CIR.0000118498.35499.B2
- Lok A et al, Benefits of Direct-Acting Antivirals for Hepatitis C. Ann Intern 2017;167(11):812-813. DOI: 10.7326/M17-1876
- Di Felice, E., Roncaglia, F., Venturelli, F. et al.The impact of introducing tyrosine kinase inhibitors on chronic myeloid leukemia survival: a population-based study. BMC Cancer 18,1069 (2018) doi:10.1186/s12885-018-4984-3
- IQVIA Institute for Human Data Science. The Global Use of Medicine in 2019 and Outlook to 2023, Jan. 2019. URL: https://www.iqvia.com/insights/the-iqvia-institute/reports/the-global-use-of-medicine-in-2019-and-outlook-to-2023, (дата обращения 20.01.2020)
- OECD, Health at a Glance 2019, URL: https://www.oecd-ilibrary.org/docserver/4dd50c09-en.pdf?expires=1579511734&id=id&accname=guest&checksum=E5A53AB89DA93221AD8A030581E1E181, (дата обращения01.2020)
- Ostwald D., Zubrzycki K., Knippel J. “Measuring the Economic Footprint of the Pharmaceutical Industry – Feasibility Study, www.wifor.de (дата обращения 20.01.2020)
- Germany’s Top 10 Exports http://www.worldstopexports.com/germanys-top-10-exports/ (дата обращения 20.01.2020)
- Alexander Schuhmacher, The Future of Pharma R&D PHARMA FOCUS ASIA ISSUE — 32 – 2018
- Развитие аптечной сети в советский период https://lektsii.org/4-24737.html, (дата обращения 20.01.2020)
- Приказ Министерства промышленности и торговли РФ от 23 октября 2009 г. N 965 «Об утверждении Стратегии развития фармацевтической промышленности Российской Федерации на период до 2020 года» https://base.garant.ru/4189282/
- Сергей Цыб: «Сейчас мы находимся в той точке, когда нам есть что предложить не только отечественному, но и международному рынку здравоохранения» http://ktovmedicine.ru/2019/1/sergey-cyb-seychas-my-nahodimsya-v-toy-tochke-kogda-nam-est-chto-predlozhit-ne-tolko-otechestvennomu-no-i-mezhdunarodnomu-rynku-zdravoohraneniya.html
- Указ Президента РФ от 7 мая 2018 г. «О национальных целях и стратегических задачах РФ». http://www.kremlin.ru/acts/bank/43027 (дата обращения 20.01.2020)
- ПРАВИТЕЛЬСТВО РОССИЙСКОЙ ФЕДЕРАЦИИ. О внесении изменений в государственную программу Российской Федерации «Развитие фармацевтической и медицинской промышленности». https://regulation.gov.ru/projects#npa=98567. 09.01.2020, (дата обращения 20.01.2020)
- OECD https://stats.oecd.org/, По РФ Росстат: https://www.gks.ru/folder/12781(дата обращения 20.01.2020)
- Workman, Drugs and Medicine Exports by Country. http://www.worldstopexports.com/drugs-medicine-exports-country/, (дата обращения 20.01.2020)
- THE PHARMACEUTICAL INDUSTRY AND GLOBAL HEALTH. International Federation of Pharmaceutical Manufacturers & Associations. URL: https://www.ifpma.org/wp-content/uploads/2017/02/IFPMA-Facts-And-Figures-2017.pdf, (дата обращения 20.01.2020)
- Здравоохранение в России.2017. Федеральная служба государственной статистики. 2018. С 8. https://www.gks.ru/storage/mediabank/zdravpdf (дата обращения 20.01.2020)
- ADVANCING HEALTH THROUGH INNOVATION. 2018 NEW DRUG THERAPY APPROVALS. https://www.fda.gov/files/drugs/published/New-Drug-Therapy-Approvals-2018_3.pdf. (дата обращения 20.01.2020)
- Annual Report 2018. The European Medicines Agency’s contribution to science, medicines and health in 2018. https://www.ema.europa.eu/en/news/ema-annual-report-2018-published (дата обращения 20.01.2020)
- Pharma R&D Annual Review 2019. URL: https://pharmaintelligence.informa.com/resources/product-content/pharma-rnd-annual-review-2019, (дата обращения 20.01.2020)
- The Biopharmaceutical Pipeline: Innovative Therapies in Clinical Development. Analysis group.URL:https://www.analysisgroup.com/globalassets/content/insights/publishing/the_biopharmaceutical_pipeline_reportpdf, (дата обращения 20.01.2020)
- Seimetz D., Heller k., Richter J., Approval of First CAR-Ts: Have we Solved all Hurdles for ATMPs? Cell Medicine.Volume 11: 1-16. DOI: 10.1177/2155179018822781
- Cohen J., China CRISPR Revolution. Science 365 (6452), 420-421. DOI: 10.1126/science.365.6452.420
- Elhassa GO, Alfarouk KO (2015) Drug Development: Stages of Drug Development J Pharmacovigilance 3: e141. doi:10.4172/2329- 6887.1000e141
- A. DiMasi, Henry G. Grabowski, Ronald W.Hansen, Innovation in the pharmaceutical industry: New estimates of R&D costs, Journal of Health Economics, 47 (2016), 20–33.
- Ekaterina Galkina Cleary E., Beierlein J., Khanuja N et al., Contribution of NIH funding to new drug approvals 2010–2016PNAS | March 6, 2018 | vol. 115 | no. 10 | 2329–2334 SOCIAL SCIENCES
- Governments and philanthropists announce new funding for neglected tropical diseases URL: https://www.who.int/neglected_diseases/news/governments-and-philanthropists-announce-new-funding/en/, (дата обращения 20.01.2020)
- Kim, Daejung, McGuire, Alistair and Kyle, Margaret (2015) Korean pharmaceutical industry policy: lessons for Korea. Research Reports, 2015-37. Korea Institute for Health and Social Affairs, Sejong, South Korea. ISBN 9788968272905
- Ekins S., Waller C, 23Bradley M. et al., Four disruptive strategies for removing drug discovery bottlenecks Drug Discovery Today Volume 18, Issues 5–6, March 2013, Pages 265-271 https://doi.org/10.1016/j.drudis.2012.10.007
- At Over $2 Million Zolgensma Is The World’s Most Expensive Therapy, Yet Relatively Cost-Effective. Forbes, https://www.forbes.com/sites/joshuacohen/2019/06/05/at-over-2-million-zolgensma-is-the-worlds-most-expensive-therapy-yet-relatively-cost-effective/#e62cb1b45f5a, (дата обращения 20.01.2020)
- Фармацевтический рынок в 2018. DSM group report. https://dsm.ru/docs/analytics/Annual_report_2018_DSM.pdf
- Science The Endless Frontier. A Report to the President by Vannevar Bush, Director of the Office of Scientific Research and Development, July 1945. https://www.nsf.gov/od/lpa/nsf50/vbush1945.htm, (дата обращения 20.01.2020)
- NIH budget https://www.hhs.gov/about/budget/fy2018/budget-in-brief/nih/index.html#budget, (дата обращения 20.01.2020)
- National Center of Advancing Translational Sciences https://ncats.nih.gov/, (дата обращения 20.01.2020)
- NIH, Office of portfolio management, https://dpcpsi.nih.gov/opa, (дата обращения 20.01.2020)
- Mowery D., Nelson D, Sampat B et al., The growth of patenting and licensing by U.S. universities: an assessment of the effects of the Bayh–Dole act of 1980. Research Policy 30 _2001. 99–119
- Mojica F., Rodriguez-Valera F., The discovery of CRISPR in archaea and bacteria The FEBS Journal 283 (2016) 3162–3169 doi:10.1111/febs.13766
- Jinek M., Chylinski K., Fonfara I., Doudna J., et al, A programmable dual RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 2012 August 17; 337(6096): 816–821.
- Le Cong, Ran F.A., Zhang F. et al, Multiplex Genome Engineering Using CRISPR/Cas Systems, Science. 2013 February 15; 339(6121): 819–823. doi:10.1126/science.1231143.
- Caribou biosciences. https://cariboubio.com/ (дата обращения 20.01.2020)
- Editas medicine. https://www.editasmedicine.com/ (дата обращения 20.01.2020)
- FDA at Glance. https://www.fda.gov/about-fda/fda-basics/fact-sheet-fda-glance, (дата обращения 20.01.2020)
- Regenerative Medicine Advanced Therapy Designation https://www.fda.gov/vaccines-blood-biologics/cellular-gene-therapy-products/regenerative-medicine-advanced-therapy-designation, (дата обращения 20.01.2020)
- Institute for Clinical and Economic Review https://icer-review.org/, (дата обращения 20.01.2020)
- McKelvey M., Orsenigo L., Pharmaceuticals as a Sectoral Innovation System. ESSY Project (European Sectoral Systems of Innovation). http://plg-group.com/wp-content/uploads/2014/03/Pharmaceuticals-as-a-Sectoral-Innovation-System-McKelvey-M.pdf. (дата обращения 20.01.2020)
- Innovative Medicine Initiative. https://www.imi.europa.eu/, (дата обращения 20.01.2020)
- Bernhard Zechendorf., Regional biotechnology – The EU biocluster study. Journal of Commercial Biotechnology (2011) 17, 209 – 217. doi: 10.1057/jcb.2011.13 ;
- Stevenage Bioscience Catalyst https://www.stevenagecatalyst.com/, (дата обращения 20.01.2020)
- Strategy for UK Life Sciences. https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/32457/11-1429-strategy-for-uk-life-sciences.pdf. (дата обращения 20.01.2020)
- 2018 DIRECTORY OF KOREAN PHARMACEUTICAL INDUSTRY, http://www.kpbma.or.kr/attach/KPBMA_Directory_2018.pdf, (дата обращения 20.01.2020)
- Kwon H,. Yang B., Godman B., Key Components of Increased Drug Expenditure in South Korea: Implications for the Future. V A UEINHEALTHREGIONALISSUES6C(2015)14 – 2 1, http://dx.doi.org/10.1016/j.vhri.2015.01.004
- Chung H., Eum S., Lee C., Firm Growth and R&D in the Korean Pharmaceutical Industry. Sustainability 2019, 11, 2865; doi:10.3390/su11102865
- Rymzo et al., The Modern Merits of South Korea’s Biopharmaceutical Industry Int J Drug Dev & Res 2016, 8:2
- Kim, Daejung, McGuire, Alistair and Kyle, Margaret (2015) Korean pharmaceutical industry policy: lessons for Korea. Research Reports, 2015-37. Korea Institute for Health and Social Affairs, Sejong, South Korea.
- The Right Place For Clinical Trials In Asia START WITH KOREA. Korea National Enterprise for Clinical Trials 2017
- Ding J., Xue Y., Liang H et al, From Imitation to Innovation: A Study of China’s Drug R&D and Relevant National Policies
- China’s Biopharmaceutical Strategy: Challenge or Complement to U.S. Industry Competitiveness? ROBERT D. ATKINSON, INFORMATION TECHNOLOGY & NNOVATION FOUNDATION | AUGUST 2019. https://itif.org/publications/2019/08/12/chinas-biopharmaceutical-strategy-challenge-or-complement-us-industry, (дата обращения 20.01.2020)
- China Pharmaceutical Guide, 13th Edition (2018), James J. pharmachinaonline.com, (дата обращения 20.01.2020)
- Ni et al. Obstacles and opportunities in Chinese pharmaceutical innovation. Globalization and Health (2017) 13:21 DOI 10.1186/s12992-017-0244-6
- Улумбекова Г.Э., Здравоохранение России. Что надо делать. Состояние и предложения. 2019-2024 гг, 2019, стр 202,


