В Российской Федерации отмечаются затруднения в доступности радиофармацевтических препаратов для пациентов в связи с недостаточным учетом особенностей этой группы препаратов и регуляторной непроработанностью правил выдачи разрешения на их производство и правил регистрации, включая правила, определяющие, когда требуется регистрация исходных материалов для производства радиофармацевтических препаратов и в каких случаях регистрация может не потребоваться. Для анализа проблем и выработки предложений о возможных способах их решения в данной работе мы проработали соответствующие требования и принципы Европейского союза, законодательство в сфере регулирования радиофармацевтических препаратов которого строится на учете отличительных свойств этой группы лекарств, в первую очередь радиоактивности.
Авторы материала:
Равиль Ниязов, специалист по разработке и регистрации лекарственных препаратов, ООО «Центр научного консультирования»
Елена Гавришина, специалист по разработке и регистрации лекарственных препаратов, ООО «Центр научного консультирования»
Маргарита Драницына, биостатистик, ООО «Центр научного консультирования»
Андрей Васильев, специалист по разработке и регистрации лекарственных препаратов, ООО «Центр научного консультирования»
Материал был опубликован в журнале «Новости GMP» № 3(20)/осень 2019
Введение
В последние годы не только в России стал снова возвращаться интерес к радиофармацевтическим препаратам, в связи с чем стало очевидно, что текущие подходы к разработке и регистрации этой важной группы лекарственных препаратов в нашей стране являются неоптимальными и не соответствуют международным стандартам и критериям, в результате чего пациенты получают к ним доступ несвоевременно, а их безопасность, эффективность и качество могут не соответствовать последним достижениям научного и технического прогресса. Именно поэтому проблема доступности радиофармацевтических препаратов (РФП) обсуждается сейчас на самом высоком государственном уровне.
Чтобы понять направление движения для устранения имеющихся пробелов в регулировании и снятии существующих барьеров для выхода на рынок при одновременном обеспечении высокого уровня безопасности, эффективности и качества РФП, целесообразно детально рассмотреть подходы к разработке и регулированию этой категории лекарств в Европейском союзе (ЕС) и сравнить действующие там нормы и положения с правовым регулированием РФП в России и в документах права Евразийского экономического союза (ЕАЭС).
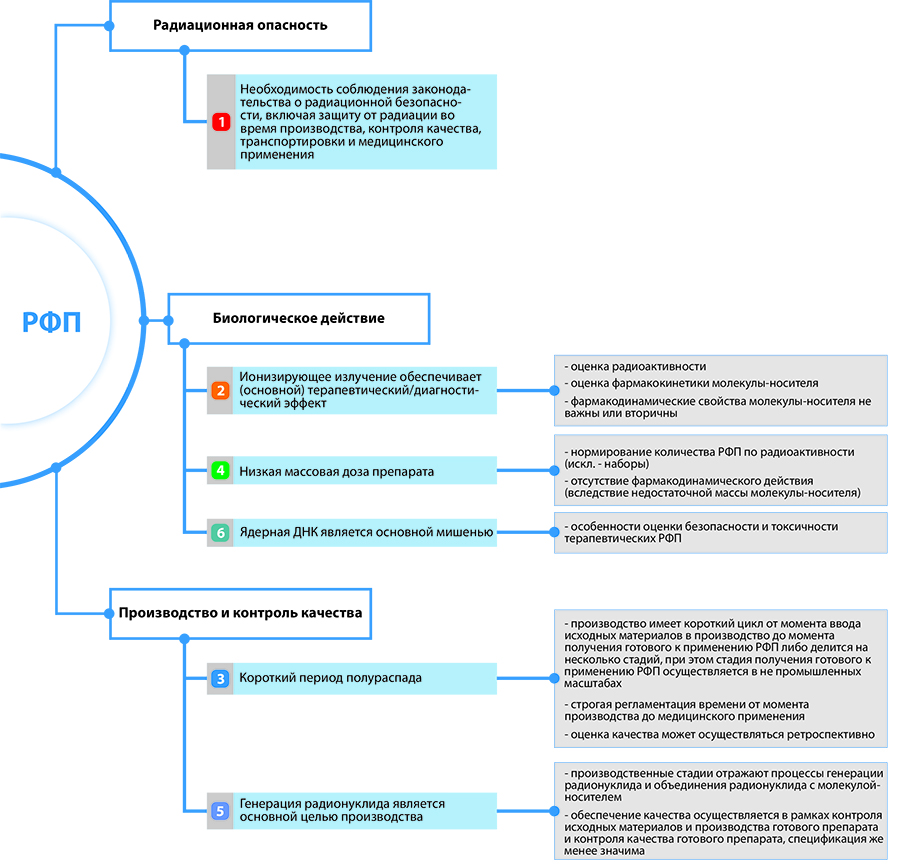
Специальные требования фармацевтического законодательства ЕС, применяющиеся к РФП, вытекают из особенностей, присущих этой группе лекарственных препаратов, которые необходимо учитывать при их производстве и контроле качества, транспортировке, медицинском применении, а также оценке их профиля безопасности и эффективности. Прежде чем перейти к детальному анализу регулирующих положений законодательства ЕС и России/ЕАЭС, целесообразно подробно осветить эти особенности.
Отличительные особенности радиофармацевтических препаратов
Очевидно, что основным признаком, отличающим РФП от других групп лекарств, является их радиоактивность. Этот признак влечет за собой все остальные особенности, определяющие подходы к регулированию вывода РФП на рынок /выпуск для медицинского применения, а также методы обеспечения качества и оценки их безопасности и эффективности.
Первая особенность: будучи радиоактивными, РФП представляют собой т. н. открытые источники, то есть содержащийся в них источник ионизирующего излучения способен оказывать влияние на окружающую среду (1), включая организм человека, будь то пациент, медицинский персонал или персонал, отвечающий за производство РФП. Это обстоятельство приводит к необходимости соблюдения законодательства о радиационной безопасности, являющегося отдельной отраслью права, и здесь не рассматривается.
Вторая особенность: поскольку медицинскую ценность (диагностическую или терапевтическую) представляет исключительно/преимущественно ионизирующее излучение, испускаемое радионуклидом, то фармакодинамические свойства молекулы – носителя радионуклида либо не важны, либо вторичны. Например, в случае флудезоксиглюкозы [18F] (прим. — следует отметить неудачность термина «флудезоксиглюкоза», присвоенного ВОЗ, вместо более привычного и понятного «фтордезоксиглюкоза»), помимо испускания позитронов, какая либо фармакологическая ценность молекулы радиоактивной флудезоксиглюкозы или нерадиоактивной «тяжелой» глюкозы отсутствует (2). Аналогично радий [223Ra] как химический элемент не представляет ценности для организма и используется только в качестве источника радиации (3). В случае ибритумомаба тиуксетана (Зевалин) – после внесения радиоактивной метки – наличие радиоактивности является основным желаемым свойством, тогда как антителозависимая клеточная и комплементзависимая цитотоксичности моноклонального антитела – носителя играют второстепенную роль в уничтожении опухолевых клеток при B-клеточной неходжкинской лимфоме (4).
Вместе с тем ценность представляют фармакокинетические свойства носителя, а именно его распределение, поскольку, как правило, пользу приносит не просто лучевое воздействие на организм, а избирательное накопление источника радиации в определенном органе или очаге с целью последующей регистрации излучения и его диагностической интерпретации либо терапевтическое воздействие ионизирующего излучения на патологические клетки. Характеристики распределения являются основным фактором отбора молекул-носителей (вторым решающим фактором отбора является их безопасность/отсутствие неприемлемой токсичности). По этой причине изучение биораспределения играет ключевую роль для понимания профиля токсичности при оценке безопасности и эффективности новых РФП.
Интересно отметить, что отсутствие или вторичность фармакодинамической активности РФП сближает эту группу лекарств с медицинскими изделиями, коими они, по сути, являются, поскольку они оказывают влияние за счет физического, а не химического воздействия. Однако подходы к их регулированию в качестве лекарств имеют исторические корни; кроме того, важную роль в сохранении такого подхода играет бо́льшая строгость и упорядоченность фармацевтического регулирования по сравнению с регулированием медицинских изделий (прим. — интересующийся читатель может обратиться к посту в Телеграм-канале Мета-Ф (https://tlgg.ru/meta_ph) от 30 июня 2019 г. (поиск по тегам #ВиО или #регуляторика), в котором глубже рассматриваются вопросы того, что считать лекарством с регуляторной точки зрения). Вместе с тем не регуляторная терминология определяет объем требований, которым должен отвечать РФП, а те риски, которые он представляет для организма человека. Другими словами, к РФП должны применяться ровно те требования, которые предъявляются к ним за рубежом в качестве лекарств, независимо от того, рассматриваются ли они с регуляторной точки зрения в качестве лекарств или медицинских изделий.
Третья особенность: в связи с пагубным влиянием радиации на биологические системы, медицинскую ценность представляют источники радиации (радионуклиды) с относительно коротким периодом полураспада, чтобы обеспечить краткосрочное воздействие излучения на организм. В случае диагностического применения лучевая экспозиция должна быть сверхкороткой. В случае терапевтического применения (онкология, иммунопатология) экспозиция может быть несколько более длительной, но все равно достаточно короткой. Это обстоятельство накладывает существенные ограничения на способы производства, стандартизации, контроля качества и промежутка времени от производства до медицинского применения.
В результате этого производство РФП имеет либо (1) очень короткий цикл, иногда исчисляющийся несколькими часами, от момента ввода исходных материалов в производство до момента получения РФП, готового к медицинскому применению, либо (2) производство делится на несколько стадий: (a) стадию получения первичного радионуклида с достаточно длительным периодом полураспада, позволяющим его хранение и транспортировку без строгих временных ограничений, (b) в ряде случаев стадию получения нерадиоактивного носителя (холодной формуляции), (c) стадию быстрого получения из первичного радионуклида вторичного радионуклида с коротким периодом полураспада, который войдет в состав РФП, готового к применению, и будет введен пациенту и (d) стадию получения готового РФП.
В первом случае РФП, готовый к применению, можно получать в промышленных масштабах с помощью стандартизированного процесса производства. Примерами являются:
- упомянутые флудезоксиглюкоза [18F], раствор для инъекций (изотоп получают из циклотрона);
- радия [223Ra] дихлорид, раствор для инъекций (изотоп получают из генератора), и
- мета-йодобензилгуанидин [131I], раствор для инъекций (изотоп получают из реактора) (5).
Если период полураспада радионуклида таких РФП очень короткий, то производство нередко приходится осуществлять в относительной близости с медицинским учреждением. Например, в случае препарата флудезоксиглюкозы [18F] желательно, чтобы между выпуском и медицинским применением прошло не более 6 часов, что накладывает соответствующие ограничения на дальность транспортировки.
Если же физический период полураспада радионуклида сверхкороткий или если получения РФП можно добиться путем «простого» объединения радионуклида с нерадиоактивным носителем, готовый к применению РФП может быть изготовлен незадолго до введения пациенту (ex temporo). Такое изготовление готового к применению РФП может осуществляться в непромышленных масштабах, например в медицинском учреждении, и предполагает использование промежуточных продуктов производства (полуфабриктов, полупродуктов), таких как радионуклидные генераторы, радиоактивные прекурсоры и наборы. Например, так могут получать технеций [99mTc] хлорид для целей внесения радиоактивной метки из радионуклидного генератора на основе молибдена [99Mo] (сам радиоактивный молибден медленно распадается с образованием радиоактивного технеция, имеющего короткий период полураспада и представляющего диагностическую ценность). Радионуклидный генератор получают промышленным способом, а готовые РФП изготавливают на его основе в индивидуальном порядке (6).
Примером получения РФП с помощью радионуклидных прекурсоров являются готовые к применению РФП на основе лютеция [177Lu] хлорида (8). Наконец, примером набора служит ибритумомаба тиуксетан (Зевалин). Он представляет собой набор из одного флакона с ибритумомаба тиуксетаном, одного флакона с ацетатом натрия, одного флакона с формуляционным буфером и одного пустого реакционного флакона (9). При этом радионуклид (иттрий [90Y]) не является частью набора и вообще не синтезируется производителем моноклонального антитела, то есть радиоактивный прекурсор поставляется отдельно производителем радионуклидного рекурсора. Такое раздельное производство требует соответствующего регулирования.
Кроме того, говоря о коротких и сверхкоротких периодах полураспада с точки зрения производства РФП следует понимать, что такая градация является качественной и определяется производственными и логистическими возможностями конкретного производителя и удаленностью медицинских учреждений, в которых будут применяться РФП. По этой причине регуляторные критерии коротких и сверхкоротких периодов полураспада отсутствуют, ибо для каждой конкретной связки «производитель – обслуживаемые медицинские учреждения» будут свои принципы градации.
Короткий период полураспада также влечет за собой особенности контроля качества. В частности, поскольку оценка микробиологического качества занимает дни или даже недели, выпуск и медицинское применение РФП происходят до получения всех результатов испытаний и лишь позволяют узнать, был ли препарат качественным на момент выпуска. Такая ретроспективная оценка позволяет инициировать расследование и принимать корректирующие меры для предотвращения брака качества в будущем. По этой же причине транспортировка готового РФП, например флудезоксиглюкозы [18F], из места производства в лечебное учреждение должна осуществляться в кратчайшие сроки.
Четвертая особенность: доза радиации, требуемая в медицинских целях, испускается столь низким количеством радионуклида (в комплексе с молекулой-носителем или без), что требуются очень небольшие массовые дозы препарата. Например, стандартная доза флудезоксиглюкозы [18F] находится в микрограммовом диапазоне (10). В результате чего стандартизация и контроль качества РФП обычно осуществляются на основании его радиоактивности, а не массового содержания. Исключением являются наборы, холодная формуляция которых контролируется с помощью стандартных подходов на основании показателей массы (11). Эта особенность также согласуется с отсутствием или вторичностью фармакодинамического действия РФП.
Пятая особенность: разделение производства на стадии «лекарственное вещество» (активная фармацевтическая субстанция) и «лекарственный препарат» менее значимо для РФП, поскольку основные усилия сосредоточены на генерации радионуклида и объединении его с молекулойносителем. В результате, несмотря на то что РФП имеет в своем составе лекарственное вещество (например, в случае препарата флудезоксиглюкоза [18F], раствор для инъекций, им является молекула флудезоксиглюкозы [18F]), в процессе получения РФП готовое лекарственное вещество обычно не выделяется и отдельно не оценивается. Обеспечение качества осуществляется в рамках контроля исходных материалов, включая получение радионуклида, получения лекарственного вещества (т. е. конъюгации радионуклида с носителем) и производства готового препарата, а также в рамках контроля качества готового препарата.
Следует отличать лекарственное вещество (действующее вещество/активную фармацевтическую субстанцию) от радионуклидного прекурсора и набора, ибо действующее вещество (active substance) – в соответствии со ст. 1(4) Директивы (11) – это любое вещество или смесь веществ, предназначенные для использования в производстве лекарственного препарата, которые при использовании в производстве последнего становятся его активным ингредиентом, предназначенным оказывать фармакологическое, иммунологическое или метаболическое действие с целью восстановления, коррекции или модификации физиологических функций или постановки диагноза.
Вместе с тем определение того, что есть действующее вещество в случае РФП на основе радионуклидных генераторов и наборов, дополнительно уточнено в законодательстве ЕС с целью более полного и прицельного регулирования их качества (см. ниже) (11).
Наконец, шестая особенность опосредована характером влияния радиоактивности на живой организм. Ионизирующее излучение вызывает поражение клеток и тканей главным образом за счет повреждения ядерной ДНК, хотя описаны и не-ДНК-мишени. Большинство пораженных клеток продолжает нормально функционировать вплоть до своей смерти при попытке выполнить митоз. Таким образом, временные рамки, в которых радиационное повреждение становится клинически явным, определяется отчасти скоростью обновления клеток.
В органах с быстрой скоростью обновления клеток (рано реагирующая здоровая ткань, например, костный мозг, эпидермис, тонкая кишка и слизистая оболочка ротоглотки) симптомы радиационного поражения (например, недостаточность костного мозга, десквамация, тошнота, рвота и диарея, а также мукозит полости рта) проявляются в течение нескольких дней и недель после острой дозы облучения. Радиационное поражение таких органов называется ранней или острой радиационной токсичностью и часто носит самоограничивающийся или обратимый характер. Вместе с тем в органах с низкой скоростью обновления клеток (поздно реагирующая здоровая ткань, например, головной мозг, спинной мозг, сердце, легкие, печень, почки, кость и мочевой пузырь) симптомы радиационного поражения (например, некроз головного мозга, паралич, фиброз перикарда и миокарда с левожелудочковой недостаточностью, интерстициальный пневномит и легочный фиброз, печеночная или почечная недостаточность, лучевой остеонекроз и геморрагический цистит) не развиваются до истечения латентного периода, равного нескольким месяцам – годам, в течение которых продолжается относительно нормальная функция органа. Радиационное поражение указанных органов называется поздней радиационной токсичностью, которая обычно прогрессирует и необратима (12). Это обстоятельство определяет способы оценки безопасности и токсичности терапевтических РФП.
Отличительные особенности РФП и их последствия для разработки и регулирования обобщены на рисунке 1. Рассмотрев свойства РФП, отличающие их от других лекарственных препаратов, можно перейти к анализу регулирования этой группы лекарств в ЕС и России. Для правильного понимания регулирования РФП в ЕС авторы статьи обратились к европейским регуляторам: представителям EMA, Агентства по регулированию лекарств и медицинских продуктов Соединенного Королевства Великобритании и Северной Ирландии (MHRA), GMP-инспектората Германии, а также специалистам Европейской ассоциации ядерной медицины (EANM).
Сначала целесообразно осветить общие положения, касающиеся вывода на рынок и производства любых лекарственных препаратов в ЕС.
Фармацевтическое законодательство ЕС
Общие положения о регистрации в ЕС Фармацевтическое законодательство ЕС, основополагающим документом которого является Директива 2001/83/EC Европейского парламента и Совета от 6 ноября 2001 г. о кодексе Сообщества о лекарственных препаратах для медицинского применения (11), закрепляет, что нормы этого законодательства применяются в случае только тех лекарств, которые (ст. 2 директивы — Директива 2001/83/EC свободно доступна на русском языке. http://pharmadvisor.ru/document/tr3537/):
- планируются к выводу на рынок государств-членов и
- либо изготавливаются промышленным способом, либо производятся с помощью метода, предусматривающего промышленный процесс.
При соблюдении обоих критериев лицо, планирующее вывод на рынок лекарства, получаемого в промышленных масштабах, обязано получить разрешение на продажу (marketing authorisation, ст. 6(1) указанной директивы). В нашей стране эта процедура обычно именуется регистрацией.
При этом для производства лекарственных препаратов для продажи также необходимо получать разрешение – разрешение (лицензия) на производство лекарственных препаратов. Разрешение на производство лекарственных препаратов в ЕС выдается только при соответствии производителя правилам надлежащей производственной практики (GMP). Директива 2001/83/EC, помимо детальной регламентации процедур регистрации, также подробно урегулирует вопросы лицензирования производства, включая вопросы соответствия GMP. Таким образом, положения о лицензировании производства и соблюдении GMP распространяются в ЕС исключительно на зарегистрированные лекарственные препараты (прим. — лекарственные препараты для клинических исследований рассмотрены ниже) и производственные площадки, производящие их. Следовательно, если лекарство не предназначено для продажи и не производится в промышленных масштабах (либо с использованием промышленного метода производства), оно не требует регистрации и производства в соответствии с GMP, например если оно производится исключительно для целей доклинических исследований. А если оно производится для получения in vitro диагностикума, то такой радиоактивный материал регулируется в качестве медицинского изделия.
Закономерно возникает вопрос, в каких случаях лекарство не удовлетворяет критериям, определяющим необходимость регистрации. Во-первых, регистрации не подлежат лекарства, производимые для личных нужд, будь то домашние заготовки или импорт (т. е. ввоз произведенного за рубежом) лекарств для личных нужд, больничное производство для лечения пациентов, проходящих лечение в этой больнице. Одновременно с этим такие лекарства должны производиться (или импортироваться) в небольших масштабах, т. е. быть предназначены для одного или нескольких пациентов. В связи с высокой значимостью положения «изготовляемые промышленным способом, либо производимые с помощью метода, предусматривающего промышленный процесс» и отсутствием в директиве более точных критериев такого способа Европейский суд (European Court of Justice) привел следующее уточнение (13):
Учитывая, что правила ЕС по регулированию лекарственных препаратов для медицинского применения ставят своей целью охрану здоровья населения, понятия «изготовляемые промышленным способом» и «производимые с помощью метода, предусматривающего промышленный процесс» нельзя интерпретировать узко. Указанные понятия должны в связи с этим включать по меньшей мере любые препарат или производство, предусматривающие промышленный процесс. Такой процесс в целом характеризуется последовательностью операций, которые могут, в частности, быть механическими или химическими, в целях получения значительных количеств стандартизированного продукта.
Такая трактовка суда справедлива в отношении любого лекарственного препарата, не только РФП.
Кроме того, в ст. 3 директивы приводятся частные случаи, на которые не распространяется директива, а значит и не требуется получение разрешения для продажи таких лекарственных препаратов, равно как и соблюдение требований GMP (т. е. не требуется регистрация). В отношении регулирования РФП важны следующие два случая, описанные в параграфах 1 и 2 ст. 3 директивы, когда регистрация не требуется:
1. Любой лекарственный препарат, изготовленный в аптеке в соответствии с медицинским назначением для отдельного пациента (известный как врачебная пропись [magistral formula]).
Такой лекарственный препарат изготавливается в индивидуальном порядке в соответствии с медицинским назначением (рецептом) для конкретного пациента. Ввиду индивидуального производства препарат не стандартизирован.
2. Любой лекарственный препарат, изготавливаемый в аптеке в соответствии с предписаниями фармакопеи и предназначенный для прямого отпуска пациентам, обслуживаемым рассматриваемой аптекой (известный как официальная формула).
Такой лекарственный препарат должен производиться в соответствии с предписаниями фармакопеи в той же аптеке, из которой он в последующем будет отпущен пациенту, обслуживаемому этой аптекой.
В отношении исключений, предусмотренных ст. 3(1) и (2) директивы, т. е. в отношении аптечного производства, Европейский суд в том же своем решении добавляет (13):
… стандартизированное производство значительных количеств лекарственного препарата для создания запаса и оптовой продажи, а также крупномасштабное или серийное производство магистральных прописей является характеристикой промышленного изготовления или производства с помощью метода, предусматривающего промышленный процесс.
Указанные исключения и их юридическая интерпретация важны в отношении РФП, поскольку многие из них производятся т. н. радиофармацевтическими аптеками, нередко располагающимися в составе больничных комплексов.
Более детально вопросы регулирования вывода на рынок и производства рассмотрены в статье «Разрешение на производство лекарств и GMP: регуляторные системы России и ЕС» (14).
Далее рассмотрим регулирование РФП, которые по правилам ЕС подлежат регистрации.
Особенности регистрации РФП в ЕС
Ст. 6(1) Директивы 2001/83/EC закрепляет, что ни один лекарственный препарат не может быть выведен на рынок государства-члена без его регистрации уполномоченными органами такого государства-члена или централизованной регистрации Европейским агентством по лекарствам (EMA).
Вместе с тем в случае РФП предусмотрено дополнительное положение (ст. 6(2)), гласящее, что регистрация, упомянутая в ст. 6(1), также необходима в отношении радионуклидных генераторов, наборов, радионуклидных прекурсоров радиофармацевтических препаратов и изготавливаемых промышленным способом радиофармацевтических препаратов.
Прежде чем перейти к анализу этого положения, целесообразно рассмотреть определения упомянутых выше понятий, которые приведены в ст. 1(6)–(9) директивы.
Радиофармацевтический препарат – любой лекарственный препарат, который, будучи готовым к применению, содержит один или несколько радионуклидов (радиоактивных изотопов), включенных с лекарственной/медицинской целью.
Радионуклидный генератор – любая система, содержащая фиксированный первичный радионуклид, из которого получают вторичный радионуклид, извлекаемый путем элюирования или иным способом и используемый для приготовления РФП.
Широко распространены радионуклидные генераторы 99Mо/99mTc. Другим примером является радионуклидный генератор галлия [68Ga] из германия [68Ge] (7). Элюируемые из генератора технеций [99mTc] и галлий [68Ga] используются для внесения радиоактивной метки в различные вещества. Внесение метки в холодную формуляцию приводит к получению лекарственного вещества. Дозирование раствора, содержащего такое радиоактивно меченое лекарственное вещество, в дозированные контейнеры приводит к получению РФП, готового к применению.
Набор – любая заготовка, подлежащая восстановлению или объединению с радионуклидами в готовом радиофармацевтическом препарате, как правило, перед его введением.
Пример – ибритумомаб тиуксетан, впоследствии объединяемый с иттрием [90Y]. Внесение метки (иттрия [90Y) в холодную формуляцию (ибритумомаб тиуксетан) приводит к получению готового лекарственного вещества. Дозирование раствора, содержащего такое радиоактивно меченое лекарственное вещество, в дозированные контейнеры приводит к получению РФП, готового к применению.
Радионуклидный прекурсор – любой другой, помимо перечисленных выше, радионуклид, произведенный для внесения радиоактивной метки в другое вещество перед введением.
Пример – лютеция [177Lu] хлорид, используемый для внесения радиоактивной метки в различные вещества (8). Внесение метки (лютеция [177Lu] хлорид) в холодную формуляцию приводит к получению готового лекарственного вещества. Дозирование раствора, содержащего такое радиоактивно меченое лекарственное вещество, в дозированные контейнеры приводит к получению РФП, готового к применению.
Наконец, под изготавливаемыми промышленным способом РФП понимаются РФП, сразу производимые готовыми к применению, т. е. в своей готовой форме дозирования, в виде которой РФП будет вводиться пациенту. Производственная площадка должна иметь разрешение (лицензию) на производство таких РФП. Примерами являются флудезоксиглюкоза [18F], раствор для инъекций, и мета-йодобензилгуанидин [131I], раствор инъекций.
Таким образом, радионуклидный генератор, набор и радионуклидный прекурсор являются предшественниками (например, промежуточными продуктами, источниками или компонентами) для получения готового РФП, который можно непосредственно вводить пациенту. Следовательно, ст. 6(2) директивы в случае радиофармацевтических препаратов, удовлетворяющих критериям ст. 2 (вывод на рынок + производство в промышленных масштабах или с использованием промышленного процесса) и не подпадающих под положения ст. 3, предусматривает необходимость регистрации не только готового препарата, но и его предшественников, если производство имеет четко очерченные стадии.
Вместе с тем ст. 7 директивы закрепляет, что «не требуется регистрировать радиофармацевтические препараты, изготавливаемые в момент применения лицом или организацией, уполномоченной в соответствии с национальным законодательством применять такие лекарственные препараты в одобренном медицинском учреждении, исключительно из зарегистрированных радионуклидных генераторов, наборов или радионуклидных прекурсоров в соответствии с инструкциями производителя».
Тем самым европейский регулятор, понимая временны́е ограничения при изготовлении готовых РФП, освобождает от необходимости регистрации готовых РФП, коль скоро они производятся из зарегистрированных радионуклидных генераторов, наборов или радионуклидных прекурсоров и при условии изготовления лицом или организацией, в соответствующем медицинском учреждении, получившем разрешение (лицензию) на такое изготовление. Эти условия должны гарантировать качество (включая подлинность, радиоактивную дозу, чистоту и микробиологическое качество) и безопасность РФП, изготовляемого таким образом.
Регистрация радионуклидных генераторов, радионуклидных прекурсоров и наборов в ЕС
Возникает закономерный вопрос, как можно зарегистрировать предшественник РФП, если клинические исследования проводятся с использованием готового препарата, а не предшественника?
Для ответа на этот вопрос целесообразно кратко рассмотреть требования к составу регистрационного досье лекарственных препаратов, регистрируемых в ЕС. Объем данных о качестве лекарственного препарата и его компонентов, включаемых в регистрационное досье, определяется их природой (получение с помощью химического синтеза, биосинтеза, выделения из биологических источников, минеральное происхождение и т. п.), тогда как объем доклинических и клинических данных определяется новизной/изученностью действующего вещества и клинического назначения. Именно этот последний аспект определяет регистрационную категорию (более правильно называемую «правовая основа регистрации») лекарственного препарата. В зависимости от правовой основы регистрации законодательство ЕС выделяет:
1. новые (оригинальные) лекарственные препараты. Необходимо предоставить полный комплект собственных доклинических и клинических данных. В рамках этой категории выделяют т. н. «смешанные досье», когда доклинические и клинические данные комплектуются на основании результатов собственных исследований и библиографических данных;
2. воспроизведенные лекарственные препараты (генерики). Собственные доклинические и клинические данные не требуются, но может потребоваться доказать биоэквивалентность по отношению к оригинальному лекарственному препарату. В случае инъекционных препаратов, представляющих собой истинные водные растворы (коими являются большинство РФП), доказывать биоэквивалентность не требуется. В случае воспроизведенных РФП следует также учитывать, что биоэквивалентность доказывается не по молярной (массовой) дозе, а по активности, поскольку, как было указано выше, массовые концентрации радиоактивных действующих веществ (АФС) в составе РФП очень низкие и могут различаться у оригинатора и генерика, однако это принципиально для данной категории препаратов при обеспечении соответствующей активности;
3. гибридные лекарственные препараты (гибриды). Гибриды отличаются от генериков тем, что имея одинаковое с оригинальным препаратом действующее вещество, могут отличаться от него по дозировке, лекарственной форме, пути введения или показанию к применению; возможно также отличие в солевых и некоторых других формах действующего вещества. В связи с этим иногда могут требоваться дополнительные данные (сверх подтверждения биоэквивалентности, если оно необходимо), для доказательства, что отличия не существенны для профиля безопасности и эффективности;
4. аналогичные биологические лекарственные препараты (биоаналоги). Эта группа пока для РФП не значима, поскольку биологических РФП немного, а их биоаналоги не разрабатываются;
5. устоявшееся лекарственное применение (в ЕАЭС – хорошо изученное медицинское применение). Доклинические и клинические модули регистрационного досье этой группы лекарственных препаратов компонуются исключительно на основании литературных данных, в связи с чем регистрационное досье таких препаратов иногда называют библиографическим. Важно отметить, что по своей полноте оно должно быть столь же полным, сколь регистрационное досье оригинального препарата, т. е. с помощью литературных источников необходимо описать все аспекты фармакодинамики, фармакокинетики, обосновать режим дозирования, безопасность и ффективность. Это отличает их от генериков, доклинический и клинический обзоры которых лаконичны, а основной акцент делается на фармацевтическую эквивалентность и биоэквивалентность;
6. фиксированные комбинации. Эта группа лекарственных препаратов представляет собой комбинацию в одной лекарственной форме действующих веществ, ранее зарегистрированных в составе однокомпонентных лекарственных препаратов. Она пока не имеет значение для РФП;
7. лекарственные препараты, регистрируемые на основании информированного согласия правообладателя. В этом случае модули 3, 4 и 5 являются полной копией ранее зарегистрированного лекарственного препарата, зарегистрированного на основании любого из вышеперечисленных оснований, и подаются на регистрацию с согласия правообладателя.
Указанные правовые основы регистрации применяются и к радионуклидным генераторам, радионуклидным прекурсорам и наборам. При этом предоставляются полные данные об их качестве (модуль 3) в индивидуальном порядке, исходя из их характеристик, и с учетом специальных уточнений, приведенных в части III.2 дополнения I к Директиве 2001/83/EC. Кроме того, регистрационное досье радионуклидных генераторов – на основании статьи 9 директивы – должно дополнительно содержать (i) общее описание системы, а также подробное описание компонентов системы, которые могут повлиять на состав или качество вторичных нуклидных препаратов, и (ii) качественные и количественные данные об элюате или сублимате.
Следует дополнительно пояснить, что законодательные и регуляторные требования к составлению регистрационного досье в части качества для подлежащих регистрации РФП (модуль 3) приводятся в нескольких источниках:
- общие требования к качеству, применимые ко всем лекарственным препаратам, приводятся в разделе 3 части I дополнения I к Директиве 2001/83/EC. Эти требования в обоснованной части применяются и к РФП, например касательно характеристики фармацевтической разработки, валидации процесса производства и аналитических методик или обоснования спецификации и т. д.;
- частные требования, уточняющие и дополняющие требования раздела 3 части I дополнения I к Директиве 2001/83/EC, применительно к РФП содержатся в части III.2 дополнения I к Директиве 2001/83/EC;
- разъяснения положений, упомянутых в предыдущих 2 пунктах, приводятся в Руководстве EMA по радиофармацевтическим препаратам (15). В нем более подробно детализируется, как следует заполнять модуль 3 регистрационного досье для различных групп РФП.
Однако правовой основой регистрации определяется именно содержание доклинического и клинического модулей (2.4–2.7, 4 и 5), а не модуля 3 «Качество», структура которого в целом универсальна. Например, радионуклидный генератор германия [68Ge] хлорида / галлия [68Ga] хлорида зарегистрирован в качестве смешанного досье (т. е. на основании комбинации собственных [доклиническое исследование биораспределения 68Ga] и литературных [все остальные доклинические и все клинические] данных) (7). Другой радионуклидный генератор – натрия молибдат [99Mo]/натрия пертехнетат [99mTc] – зарегистрирован в качестве воспроизведенного без каких-либо доклинических и клинических исследований (оригинальный препарат – Drytec, GE Healthcare Limited) (6). Радионуклидный прекурсор лютеция [177Lu] хлорид зарегистрирован EMA на основании исключительно литературных данных о его безопасности и эффективности (библиографическое досье) (8). Другой радионуклидный прекурсор – иттрия [90Y] хлорид – зарегистрирован по смешанному досье (16). Набор ибритумомаба тиуксетана зарегистрирован EMA в качестве оригинального биотехнологического препарата (4), однако наборы могут регистрироваться и в качестве генериков или библиографических досье (т. е. без собственных исследований) (17), (18).
Более подробное обсуждение регуляторных аспектов правовой основы регистрации лекарственных препаратов приведено в работе Ниязов и др. (2019) (19).
В связи с существованием РФП, регистрация которых может не требоваться: (1) изготавливаемых в радиофармацевтических аптеках, в том числе при больницах, в непромышленных масштабах и без использования промышленного метода, и (2) изготавливаемых уполномоченным лицом в учреждении здравоохранения с использованием зарегистрированных радионуклидных генераторов, радионуклидных прекурсоров и наборов, целесообразно кратко осветить вопросы обеспечения их качества, безопасности и эффективности в ЕС в отсутствие регистрационного и GMP-контроля.
Регулирование обращения РФП, не подлежащих регистрации, в ЕС
Несмотря на существование подгрупп РФП, не требующих регистрации, законодательство ЕС тем не менее предусматривает определенные меры, направленные на защиту интересов пациентов, применяющих такие РФП. Ввиду ограниченного влияния на здоровье населения предусмотрены соответствующие пропорциональные меры по их регулированию; такие меры находятся в компетенции отдельных государств-членов и не гармонизированы. В частности, именно в связи с (1) маломасштабностью или отсутствием промышленного метода производства РФП либо (2) производством готовых к применению РФП из зарегистрированных полупродуктов эти категории РФП не регулируются централизованным законодательством ЕС, тем самым освобождаются от обязательной регистрации (т. е. освобождаются от всеобъемлющего доказательства их безопасности, эффективности и качества) и производства в соответствии с GMP.
Локальные правила обычно являются менее строгими, но в некоторых случаях могут быть эквивалентными правилам GMP. В частности, радиофармацевтические аптеки и производственные подразделения учреждений здравоохранения обязаны получать разрешение (лицензию) на производство. Такое разрешение выдается соответствующим уполномоченным органом при соблюдении менее строгих требований, чем предусмотренные Директивой 2001/83/EC и применяемые в случае лекарств, подлежащих регистрации.
Вместе с тем, поскольку государства-члены сталкивались и продолжают сталкиваться с одними и теми же проблемами регулирования не подлежащих регистрации лекарственных препаратов были выработаны некоторые общие рекомендации и стандарты, исполнение которых носит добровольный характер. Однако если уполномоченные органы государств – членов ЕС ссылаются на эти стандарты в своих правилах и регламентах, то их соблюдение становится обязательным. Как правило, для получения разрешения на производство не подлежащих регистрации РФП уполномоченные органы требуют соблюдения указанных стандартов. Выдача такого разрешения на производство может сопровождаться инициирующей выездной инспекцией производственной площадки на предмет соответствия установленным требованиям.
Рассмотрим существующее регулирование не подлежащих регистрации РФП, производимых в радиофармацевтических аптеках или производственных подразделениях лечебных учреждений. Основным документом в этой области является Резолюция CM/Res(2016)1 Совета Министров Совета Европы о требованиях по обеспечению качества и безопасности лекарственных препаратов, изготавливаемых в аптеках для удовлетворения особых нужд пациентов (20). Этот документ устанавливает общие стандарты регулирования работы аптек, производящих любые лекарственные препараты, освобожденные от требования о регистрации, то есть применяется не только к РФП. Документ является общерегуляторным, устанавливая общие принципы аптечного производства, и отсылочным. Следует отметить, что РФП в самой резолюции не упоминаются. В части установления технических стандартов он ссылается на два основных источника таких стандартов: тексты Европейской фармакопеи, применимые к аптечному производству, и Руководство по надлежащим практикам изготовления лекарственных препаратов в учреждениях здравоохранения (PE 010-4; его приложение 3 специально посвящено РФП, изготовляемым в учреждениях здравоохранения), составленное Системой сотрудничества по фармацевтическим инспекциям (PIC/S) (21). И в Европейской фармакопее, и в руководстве PE 010-4 содержатся положения о производстве и обеспечении качества изготовляемых РФП.
Кроме того, в ЕС существует Европейская ассоциация ядерной медицины (EANM) – некоммерческая организация, в числе прочего занимающаяся координацией и методической поддержкой любой деятельности, связанной с разработкой, производством и применением РФП. Она выработала ряд научно-технических стандартов, призванных упорядочить работу радиофармацевтических аптек и производственных подразделений учреждений здравоохранения, занимающихся изготовлением РФП, включая:
1. Руководства по действующей надлежащей радиофармацевтической практике (cGRPP) при изготовлении радиофармацевтических препаратов (22). Документ применяется как подлежащим, так и не подлежащим регистрации РФП (включая такие подлежащие регистрации РФП, как ПЭТ-РФП).
2. Указания по действующей надлежащей радиофармацевтической практике (cGRPP) при маломасштабном изготовлении радиофармацевтических препаратов (23). Документ призван регламентировать изготовление РФП, не предназначенных для коммерческих целей или реализации, и тем самым не подлежащих регистрации.
Примером таких РФП являются радиоактивно меченые лекарственные препараты, исследуемые в доклинических или клинических исследованиях. Внесение радиоактивной метки направлено на оценку тканевого распределения с целью характеристики фармакокинетического профиля действующего вещества нерадиофармацевтического лекарственного препарата.
3. Указания по действующей надлежащей радиофармацевтической практике (cGRPP) при маломасштабном изготовлении радиофармацевтических препаратов с использованием автоматизированных модулей: европейская перспектива (24). Сфера применения документа совпадает с документом из предыдущего пункта.
Полезные сведения по проблеме также можно почерпнуть из Европейского руководства по ядерной медицине (25).
Наконец, завершим рассмотрение вопросов производства РФП в ЕС их регулированием для целей изучения в клинических исследованиях.
Регулирование исследуемых РФП в ЕС
Регулирование производства РФП, исследуемых в клинических исследованиях (исследуемые РФП), во многом схоже с регулированием, описанным выше, в частности применяются те же или похожие научно-технические стандарты. Регулирование строится на следующих предпосылках.
Для любого экспериментального изучения лекарственных препаратов на людях (включая РФП) необходимо получать разрешение на проведение клинического исследования. Поскольку в клиническом исследовании используются незарегистрированные лекарственные препараты либо зарегистрированные лекарственные препараты применяются по незарегистрированным показаниям или режимам дозирования, в целях защиты здоровья и благополучия субъектов клинических исследований законодательство ЕС (26), (27) предусматривает необходимость получения разрешения на производство таких лекарственных препаратов, исследуемых в клинических исследованиях. Разрешение выдается на условиях соблюдения правил GMP, применимых к исследуемым лекарственным препаратам (28), (29), (30).
Вместе с тем получать разрешение на производство исследуемого РФП не требуется:
- в случае изготовления РФП из радиоактивных генераторов, наборов или радионуклидных прекурсоров в соответствии с инструкциями производителей, применяемых в качестве диагностических исследуемых лекарственных препаратов, если указанный процесс осуществляется в больницах, медицинских центрах или клиниках фармацевтическими работниками или другими лицами, имеющими законное разрешение выполнять в рассматриваемом государстве-члене такие процессы, и если исследуемые лекарственные препараты предназначены для применения исключительно в больницах, медицинских центрах и клиниках, принимающих участие в том же клиническом исследовании в том же государстве-члене. При этом получать разрешение на производство самих радиоактивных генераторов, наборов или радионуклидных прекурсоров требуется;
- в случае изготовления лекарственных препаратов, производимых в аптеке, в целях применения в качестве исследуемых лекарственных препаратов, если указанный процесс осуществляется в больницах, медицинских центрах или клиниках, уполномоченных законом осуществлять в заинтересованном государстве-члене такие процессы, и если исследуемые лекарственные препараты предназначены для применения исключительно в больницах, медицинских центрах и клиниках, принимающих участие в том же клиническом исследовании в том же государстве-члене.
Как видно, подходы регулирования исследуемых РФП схожи с таковыми, предназначенными для вывода на рынок и применения в рутинной практике (т. е. не в экспериментальных условиях).
Следует отметить, что Регламент (EC) № 536/2014 (27), который с 2020 г. начнет регулировать назначение клинических исследований в ЕС, содержит более четкое разграничение понятий «производство» и «изготовление» применительно к РФП. Под изготовлением понимаются «простые» процессы, например внесение радиоактивной метки, тогда как производство подразумевает процессы химического и ядерного синтеза.
Детально рассмотрев регулирование РФП в ЕС, целесообразно проанализировать пробелы регулирования этой категории лекарств в России и ЕАЭС и предложить потенциальные механизмы в целях совершенствования регулирования, чтобы повысить доступность РФП для пациентов, получающих медицинскую помощь в нашей стране.
Ситуация в России и ЕАЭС
Общие вопросы регистрации
По сравнению с ЕС в России столь четкая правовая регламентация вопросов регистрации и производства РФП в Федеральном законе от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств» (далее – ФЗ-61) отсутствует. В частности, в соответствии с п. 1 ч. 2 ст. 13 государственной регистрации подлежат все лекарственные препараты, впервые подлежащие вводу в обращение в Российской Федерации. При этом под обращением понимается, согласно ст. 1 ФЗ-61 – разработка, доклинические исследования, клинические исследования, экспертиза, государственная регистрация, стандартизация и контроль качества, производство, изготовление, хранение, перевозка, ввоз в Российскую Федерацию, вывоз из Российской Федерации, реклама, отпуск, реализация, передача, применение, уничтожение лекарственных средств. То есть независимо от того, подлежат они выводу на рынок для их продажи или нет, и независимо от масштаба их производства или использования промышленного процесса, любые лекарственные препараты, в т. ч. любые РФП, подлежат регистрации.
Вместе с тем на основании п. 1 и 6 ч. 5 той же статьи регистрации не подлежат:
(a) лекарственные препараты, изготовленные аптечными организациями, <…> индивидуальными предпринимателями, которые имеют лицензию на фармацевтическую деятельность, по рецептам на лекарственные препараты и требованиям медицинских организаций, и
(b) радиофармацевтические лекарственные препараты, изготовленные непосредственно в медицинских организациях в порядке, установленном уполномоченным федеральным органом исполнительной власти.
При этом определения понятия «изготовление» нет ни в ФЗ-61, ни в подзаконном акте, принятом для развития положений п. 6 ч. 5 ст. 13 ФЗ-61, – о порядке изготовления радиофармацевтических лекарственных препаратов непосредственно в медицинских организациях. Последний утвержден приказом Минздрава России (31), однако он не содержит каких-либо частных положений, касающихся производства РФП в условиях производственных аптек, не считая необходимости соблюдения норм радиационной безопасности.
В России отсутствуют требования к содержанию регистрационных досье РФП, аналогичные таковым, используемым в ЕС и учитывающим особенности этой группы лекарств, перечисленные выше.
Вопросы производства исследуемых РФП для клинических исследований в России не урегулированы, поскольку лицензирование производства исследуемых лекарственных препаратов для клинических исследований в целом является серой зоной фармацевтического законодательства Российской Федерации.
В ЕАЭС, несмотря на то что документы, регламентирующие регистрацию лекарственных препаратов, в целом основаны на документах ЕС, именно эти аспекты, определяющие сферу применения, взяты из ФЗ-61 и имеют те же изъяны. Вместе с тем положительным моментом Правил регистрации и экспертизы лекарственных средств для медицинского применения в Евразийском экономическом союзе (далее – Правила регистрации Союза) (32) является то, что в них содержатся детальные требования к содержанию регистрационного досье, включая положения, учитывающие особенности РФП. Эти требования, содержащиеся в приложении № 1 к Правилам регистрации Союза, были почти в полном объеме заимствованы из дополнения I к Директиве 2001/83/EC.
Меры для поддержки вывода РФП на рынок России
Рассмотрев подробно регулирование в ЕС и ситуации в России, а также видя недостаточное производство и применение РФП вследствие регуляторных барьеров, можно выделить основные области регулирования, нуждающиеся в реформировании для создания благоприятной почвы для развития ядерной медицины.
На наш взгляд, во избежание дублирования и поскольку Правила регистрации Союза станут с 2021 г. единственным документом, регламентирующим регистрацию в России лекарственных препаратов для медицинского применения, любые усилия по совершенствованию регулирования целесообразно сосредоточить на документах, составляющих право ЕАЭС, поскольку эти документы превалируют над федеральным законодательством (если не предусмотрены специальные исключения). Кроме того, документы ЕАЭС уже сейчас гораздо более обширны и проработаны с точки зрения введения общих стандартов безопасности, эффективности и качества лекарств.
На основании вышеизложенного и принимая во внимание существующие пробелы в российском и евразийском законодательствах, регламентирующих регистрацию и производство РФП, целесообразно принять следующие меры:
1. установить в Правилах регистрации Союза необходимость регистрации только тех лекарств, которые выводятся на рынок для продажи и производятся в промышленных масштабах или с применением промышленного метода производства;
2. уточнить ситуации, когда производимые в аптеках (в т. ч. радиофармацевтических) лекарственные препараты не требуют регистрации;
3. уточнить в Правилах регистрации Союза категории РФП, подлежащие и не подлежащие регистрации, аналогично положениям ЕС. В частности, целесообразно предусмотреть необходимость регистрации радионуклидных генераторов, радионуклидных прекурсоров и наборов, а также дополнить требования, предъявляемые к регистрационному досье радионуклидных генераторов;
4. предусмотреть необходимость использования зарегистрированных в соответствии с фармацевтическим законодательством радионуклидных генераторов, радионуклидных прекурсоров и (или) наборов при изготовлении для собственных нужд РФП, не требующих регистрации, в учреждениях здравоохранения.
Дополнительно следует отметить, что возможность самостоятельной (т. е. не в составе лекарственного препарата) регистрации радионуклидных генераторов и радионуклидных прекурсоров в качестве лекарств позволила бы внести вклад в решение проблемы недостаточного использования в России радиоактивно меченых исследуемых веществ в клинических исследованиях для оценки биодоступности и распределения, путей экскреции, профиля метаболитов и материального баланса новых терапевтических молекул, поскольку получение этих данных является обязательным компонентом разработки любых новых низкомолекулярных и некоторых биологических лекарств за рубежом;
5. ввести научно-технические стандарты, которые бы полностью воспроизводили или были эквивалентны таковым, установленным Международным агентством по атомной энергии (МАГАТЭ), ВОЗ, EMA, EANM и Европейской фармакопеи в отношении различных категорий РФП;
6. при внедрении различных общих регуляторных требований следует учитывать вышеперечисленные особенности РФП, которые могут сделать соблюдение таких требований невозможным. В частности, 100%-ная государственная оценка качества серий (т.н. сертификация) к РФП практически не применима и вызовет ненужные затруднения при выпуске лекарств на рынок.
В отношении введения научно-технических стандартов следует дополнительно отметить следующую проблему: ряд отечественных специалистов иногда пытается занизить научно-технические требования к РФП (и не только), чтобы некоторые существующие лекарственные препараты, не в полной мере отвечающие общемировым научным стандартам, могли соответствовать локальным заниженным требованиям, однако такие послабления научно не обоснованы и неминуемо ведут к недостаточной безопасности, эффективности и качеству, угрожая тем самым здоровью пациентов.
Научные принципы и положения документов ВОЗ, МАГАТЭ, EMA, EANM и Европейской фармакопеи необходимо принимать как есть, поскольку они являются научно-техническими стандартами, то есть отражают объективную реальность и обычно не являются консенсусными документами. Определенная гибкость возможна только в случае регуляторных требований (например, сроки оценки регистрационного досье, документы, которые должны находиться на производственной площадке или предоставляться в составе регистрационного досье, возможность применения препарата без регистрации при определенных условиях, требования к подтверждению биоэквивалентности воспроизведенных препаратов), поскольку регуляторные документы призваны упорядочить поведение различных групп людей в процессе изучения, производства, контроля качества и регистрации лекарств.
Кроме того, на уровне ЕАЭС целесообразно принять рекомендательные документы, которые бы упорядочили изготовление лекарств в аптеках в целом и изготовление РФП в радиофармацевтических аптеках и учреждениях здравоохранения в частности. Целесообразно использовать текущий опыт PIC/S, Европейской фармакопеи и EANM.
Заключение
В настоящей работе мы осветили текущие проблемы регулирования обращения РФП в России, а также рассмотрели соответствующие общие и частные правила ЕС, регламентирующие разработку, регистрацию и производство этой важной группы лекарственных препаратов. Наш анализ свидетельствует, что подходы к регулированию между ЕС и Россией сильно рознятся, что может являться одной из причин существования избыточных барьеров при выводе РФП на рынок России. Мы попытались выработать некоторые предложения, которые, на наш взгляд, могли бы устранить некоторые барьеры, упорядочить и индивидуализировать регуляторные подходы с учетом особенностей РФП, тем самым способствуя их своевременному выводу на рынок при надлежащем обеспечении их качества, безопасности и эффективности.
В работе не рассмотрены вопросы регулирования доклинических и клинических исследований РФП, в том числе в отношении каких РФП, в каких случаях и в каком объеме требуется проводить такие исследования. Ввиду обширности темы она заслуживает отдельной публикации.
Благодарности
Авторы выражают благодарность Agnès Saint-Raymond, начальнику международного отдела EMA, Hiral Panchani, специалисту регуляторной службы MHRA и Franz Schönfeld, GMP-инспектору Правительства Верхней Франконии в разъяснении некоторых вопросов регулирования радиофармацевтических препаратов в ЕС, а также Елене Зелинской, GMP-эксперту Ion Beam Applications в России, за помощь в организации сбора материалов для подготовки публикации, а также Галине Евгеньевне Кодиной, заведующей отделом радиационных технологий медицинского назначения ФМБЦ им. Бурназяна.
Литература
- Государственный комитет СССР по стандартам. ГОСТ 15484-81 Излучения ионизирующие и их измерения. Термины и определения (с Изменением N 1). Консорциум «Кодекс». [В Интернете] 01 01 1982 г. [Цитировано: 10 август 2019 г.] http://docs.cntd.ru/document/1200015267.
- U.S. Food and Drug Administration. Approval Date(s) and History, Letters, Labels, Reviews for NDA 021870. Drugs@FDA: FDA Approved Drug Products. [Online] June 27, 2019. [Cited: August 10, 2019.] https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=021870.
- European Medicines Agency. European Public Assessment Report for Xofigo (radium 223Ra dichloride). Official web-site of European Medicines Agency. [Online] October 11, 2018. [Cited: August 10, 2019.] https://www.ema.europa.eu/en/medicines/human/EPAR/xofigo.
- —. European Public Assessment Report for Zevalin (ibritumomab tiuxetan). Official web-site of EMA. [Online] December 12, 2017. [Cited: August 10, 2019.] https://www.ema.europa.eu/en/medicines/human/EPAR/zevalin.
- UK Medicines and Healthcare Products Regulatory Agency. Summary of Product Characteristics for Meta-Iodobenzylguanidine (131I) for Therapeutic Use 185 – 740 MBq/ml solution for infusion or solution for injection. Official web-site of the MHRA. [Online] May 16, 2017. [Cited: August 10, 2019.] http://www.mhra.gov.uk/home/groups/spcpil/documents/spcpil/con1496989025602.pdf
- Coordination Group for Mutual Recognition and Decentralised Procedures — Human. Public Assessment Report (Scientific discussion) for Montek, Radionuclide generator, 10-40 GBqSodium (99Mo) molybdate/sodium pertechnetate (99mTc), DK/H/1741/001/DC. Official web-site of the Heads of Medicines Agencies. [Online] June 17, 2013. [Cited: August 10, 2019.] https://mri.cts-mrp.eu/Human/Downloads/DK_H_1741_001_PAR.pdf.
- —. Public Assessment Report (Scientific discussion) for Galliapharm (Germanium (68Ga) chloride, Gallium (68Ga) chloride), DK/H/2294/001/DC. Heads of Medicines Agencies. [Online] October 28, 2014. [Cited: August 28, 2019.] https://mri.cts-mrp.eu/Human/Downloads/DK_H_2294_001_PAR_2of2.pdf.
- European Medicines Agency. European Public Assessment Report for Lumark (lutetium (177Lu) chloride). Official web-site of EMA. [Online] January 14, 2019. [Cited: August 10, 2019.] https://www.ema.europa.eu/en/medicines/human/EPAR/lumark.
- —. European Public Assessment Report for Zevalin (ibritumomabe tiuxetan). Official web-site of EMA. [Online] [Cited: August 10, 2019.]
- The [18F]fluorodeoxyglucose method for the measurement of local cerebral glucose utilization in man. Reivich M., Kuhl D., Wolf A., Greenberg J., Phelps M., Ido T., et al. 127-37, s.l. : Cir Res, 1979 Jan, Vol. 44(1).
- European Parliament and of the Council. Directive 2001/83/EC of the European Parliament and of the Council of 6 November 2001 on the Community code relating to medicinal products for human use. EUR-Lex. [Online] 2001. [Cited: July 8, 2019.] https://eur-lex.europa.eu/legal-content/EN/TXT/?qid=1562546994596&uri=CELEX:02001L0083-20190128.
- U.S. Food and Drug Administration. Nonclinical Evaluation of Late Radiation Toxicity of Therapeutic Radiopharmaceuticals. Official web-site of FDA. [Online] November 25, 2011. [Cited: August 10, 2019.] https://www.fda.gov/media/72237/download.
- European Court of Justice. Judgment of the Court (Third Chamber) of 16 July 2015 (request for a preliminary ruling from the Stockholms tingsrätt (Sweden))– Abcur AB v Apoteket Farmaci AB (C-544/13), Apoteket AB and Apoteket Farmaci AB (C-545/13). [Online] July 16, 2015. [Cited: August 9, 2019.] http://curia.europa.eu/juris/liste.jsf?num=C-544/13&language=EN.
- Разрешение на производство лекарств и GMP: регуляторные системы России и ЕС. Ниязов Р. Р., Драницына М. А., Васильев А. Н., Гавришина Е. В. 1, г. Москва : Специальный выпуск журнала «Новости GMP» — «Лекарственные средства и надлежащие практики GxP», 2019 г., Т. 1. https://aphs.ru/zhurnaly/
- Quality Working Party of Committee for Medicinal Products for Human Use. Guideline on radiopharmaceuticals — Revision 1. Official web-site of EMA. [Online] November 26, 2008. [Cited: August 13, 2019.] https://www.ema.europa.eu/en/radiopharmaceuticals.
- European Medicines Agency. European public assessment report (EPAR) for Yttriga (yttrium [90Y] chloride). Official web-site of EMA. [Online] 14 2014. [Cited:Augustus 10, 2019.] https://www.ema.europa.eu/en/medicines/human/EPAR/yttriga.
- Coordination Group for Mutual Recognition and Decentralised Procedures — Human. Public Assessment Report (Scientific discussion) for Renoscint MAG3, Kit for radiopharmaceutical preparation 1 mg (Betiatide), DK/H/2703/001/DC. Official web-site of the Heads of Medicines Agencies. [Online] January 30, 2018. [Cited:August 10, 2019.] https://mri.cts-mrp.eu/Human/Downloads/DK_H_2703_001_PAR.pdf.
- —. Public Assessment Report for Tektrotyd (HYNIC-[D-Phe1,Tyr3-Octreotide] trifluoroacetate), SE/H/1509/01/DC. Official web-site of Heads of Medicines Agencies. [Online] May 24, 2016. [Cited: August 10, 2019.] https://docetp.mpa.se/LMF/Tektrotyd%20kit%20for%20radiopharmaceutical%20preparation%20ENG%20PAR_09001be681383ac7.pdf.
- Проблемы приведения регистрационного досье в соответствие требованиям Правил регистрации и экспертизы Союза. Ниязов Р. Р., Рождественский Д. А., Горячев Д. В., Ефремова И. Н., Кабденова А. Т., Васильев А. Н., Гавришина Е. В., Драницына М. А., Куличев Д. А. 8-20, Москва : Ремедиум, 2019 г., Т. 5.
- Committee of Ministers. Resolution CM/Res(2016)1 on quality and safety assurance requirements for medicinal products prepared in pharmacies for the special needs of patients. Official web-site of the European Directorate for the Quality of Medicines and Healthcare. [Online] June 1, 2016. [Cited: August 13, 2019.] https://www.edqm.eu/sites/default/files/resolution_cm_res_2016_1_quality_and_safety_assurance_requirements_for_medicinal_products_prepared_in_pharmacies.pdf.
- Pharmaceutical Inspection Co-Operation Scheme. Guide to good practices for the preparation of medicinal products in healthcare establishments (PE 010-4). Official web-site of PIC/S. [Online] March 1, 2014. [Cited: August 13, 2019.] https://www.picscheme.org/layout/document.php?id=156.
- EANM Radiopharmacy Committee. Guidelines on current good radiopharmacy practice (cGRPP) in the preparation of radiopharmaceuticals. Official web-site of EANM. [Online] 2007. [Cited: August 13, 2019.] https://eanm.org/publications/guidelines/gl_radioph_cgrpp.pdf.
- Guidance on current good radiopharmacy practice (cGRPP)for the small-scale preparation of radiopharmaceuticals. Elsinga P., Todde S., Penuelas I., Meyer G., Farstad B., Faivre-Chauvet A., Mikolajczak R., Westera G., Gmeiner-Stopar T., Decristoforo C., The Radiopharmacy Committee of the EANM. s.l. : Eur J Nucl Med Mol Imaging, 2010. DOI 10.1007/s00259-010-1407-3.
- Guidance on current good radiopharmacypractice for the small-scale preparation ofradiopharmaceuticals using automatedmodules: a European perspective. Aerts J., Ballinger J. R., Behe M., Decristoforo C., Elsinga P. H., Faivre-Chauvet A., Mindt T. L., Kolenc Peitl P., Todde S. C., and Koziorowski J. 615-620, s.l. : Journal of Labelled Compounds and Radiopharmaceuticals, 2014, Vol. 57. DOI: 10.1002/jlcr.3227.
- European Association of Nuclear Medicine (EANM) and UEMS Section and European Board of Nuclear Medicine (UEMS/EBNM). European Nuclear Medicine Guide. Official web-site of EANM. [Online] European Association of Nuclear Medicine (EANM), 2018. [Cited: August 13, 2019.] https://www.nucmed-guide.app/#!/home.
- Directive 2001/20/EC of the European Parliament and of the Council of 4 April 2001 on the approximation of the laws, regulations and administrative provisions of the Member States relating to the implementation of good clinical practice… EUR-Lex: Access to European Union law. [Online] August 7, 2009. [Cited: August 13, 2019.] https://eur-lex.europa.eu/legal-content/EN/TXT/?qid=1565672178796&uri=CELEX:02001L0020-20090807.
- European Parliament and of the Council. Regulation (EU) No 536/2014 of the European Parliament and of the Council of 16 April 2014 on clinical trials on medicinal products for human use, and repealing Directive 2001/20/EC. EUR-Lex: Access to European Union Law. [Online] May 27, 2014. [Cited: August 13, 2019.] https://eur-lex.europa.eu/legal-content/EN/TXT/?qid=1565672078939&uri=CELEX:02014R0536-20140527.
- European Commission. Commission Directive 2003/94/EC of 8 October 2003 laying down the principles and guidelines of good manufacturing practice in respect of medicinal products for human use and investigational medicinal products for human use. EUR-Lex: Access to European Union law. [Online] October 8, 2003. [Cited: August 13, 2019.] https://eur-lex.europa.eu/legal-content/EN/TXT/?qid=1565672387895&uri=CELEX:32003L0094.
- —. Commission Delegated Regulation (EU) 2017/1569 of 23 May 2017 supplementing Regulation (EU) No 536/2014 of the European Parliament and of the Council by specifying principles of and guidelines for good manufacturing practice for IMP for human use. EUR-Lex: Access to European Union law. [Online] May 23, 2017. [Cited: August 13, 2019.] https://eur-lex.europa.eu/legal-content/EN/TXT/?qid=1565672631123&uri=CELEX:32017R1569.
- —. Detailed Commission guidelines on good manufacturing practice for investigational medicinal products for human use, pursuant to the second subparagraph of Article 63(1) of Regulation (EU) No 536/2014. EudraLex — Volume 10 — Clinical trials guidelines. [Online] December 8, 2017. [Cited: August 13, 2019.] https://ec.europa.eu/health/sites/health/files/files/eudralex/vol-10/guideline_adopted_1_en_act_part1_v3.pdf.
- Министерства здравоохранения России. Приказ Министерства здравоохранения РФ от 27 апреля 2015 г. № 211н «Об утверждении Порядка изготовления радиофармацевтических лекарственных препаратов непосредственно в медицинских организациях». ГАРАНТ.РУ: информационной-правовой портал. [В Интернете] 30 июня 2015 г. [Цитировано: 13 августа 2019 г.] https://www.garant.ru/products/ipo/prime/doc/70960080/.
- Совет Евразийской экономической комиссии. Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 78 «О правилах регистрации и экспертизы лекарственных средств для медицинского применения». Акты в сфере обращения лекарственных средств Евразйского экономического союза. [В Интернете] 2019 г. [Цитировано: 27 июль 2019 г.] http://www.eurasiancommission.org/ru/act/texnreg/deptexreg/LS1/Pages/drug_products.aspx.
