Данная статья актуальна в отношении правил, установленных действующим законодательством Российской Федерации на момент написания (август 2021 года). Цель статьи заключается в том, чтобы инициировать дискуссию между всеми участниками рынка лекарственных средств (ЛС) на тему выработки четких принципов взаимодействия и единого понимания требований к хранению и транспортировке продукции.
Введение

Компания: АО НПК «Катрен».
После того как лекарственное средство было выпущено на рынок, критически важным показателем, подтверждающим его качество, становится соблюдение установленного для него режима хранения. На всей цепи поставки от каждого из ее участников, начиная от производителя, строго требуется уделять пристальное внимание контролирующим мерам по соблюдению климатических условий хранения. К ним относятся:
- обеспечение необходимых условий хранения,
- проведение картирования для определения мест размещения датчиков контроля,
- рутинный контроль и его метрологическое сопровождение,
- хранение и обеспечение целостности данных сведений, полученных в результате мониторинга.
Как правило, у дистрибьюторов ассортиментная линейка товаров значительно шире, чем у производителей. Очень часто производители выпускают продукты только одной группы хранения и поэтому не всегда сталкиваются при хранении и транспортировке с необходимостью сортировки товара по группам в зависимости от заявленного режима хранения. Проблемы такого рода начинают массово встречаться и становятся более существенными на последующих этапах обращения, на которых ЛС проводят большую часть своего жизненного цикла.

Решить задачу стандартизации режимов хранения на этапах обращения призваны требования по изучению стабильности ЛС[1].
Системы GxP очень часто презентуют как поэтапные надлежащие фармацевтические практики, направленные на обеспечение тех качественных характеристик ЛС, которые были заложены в него на этапе разработки.
Увы, между действующими в настоящий момент правилами по изучению стабильности и правилами хранения и транспортировки[2] такая четкая прослеживаемость не наблюдается.
Проблема №1. Трактовка терминов
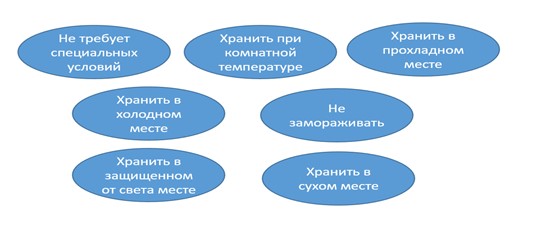
Проблема понимания и различной интерпретации условий хранения в фарминдустрии существует давно, даже можно сказать, что она уже утряслась. Тем не менее именно этот момент является одним из самых ярких противоречий между правилами по изучению стабильности и правилами хранения ЛС. Одним из постулатов в своде правил по изучению стабильности является неприемлемость использования для декларирования условий хранения ЛС таких формулировок, как «комнатная температура», «прохладное место», «холодное место», «условия окружающей среды». Вместо этого должны указываться конкретные температурные диапазоны, которые будут понятны каждому, от пациента до проверяющего из уполномоченного органа. Но в ОФС 1.1.0010.18 «Хранение лекарственных средств» все же имеются детальные расшифровки приведенных выше формулировок. Это однозначно намекает на легитимность их использования и провоцирует участников рынка на их применение, что в результате может приводить к возникновению спорных ситуаций.
Проблема №2. Гармонизация и стандартизация
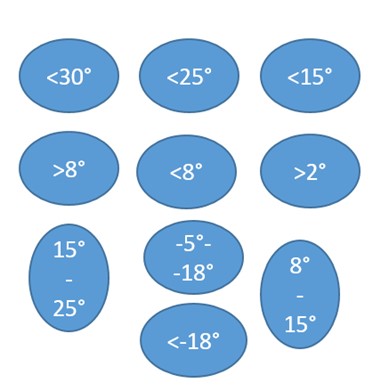 Еще одним противоречивым моментом является то, что в ОФС 1.1.0010.18 «Хранение лекарственных средств» указано множество возможных температурных режимов хранения ЛС, а согласно ОФС.1.1.0009.18 «Стабильность и сроки годности» рекомендуется устанавливать только следующие режимы хранения:
Еще одним противоречивым моментом является то, что в ОФС 1.1.0010.18 «Хранение лекарственных средств» указано множество возможных температурных режимов хранения ЛС, а согласно ОФС.1.1.0009.18 «Стабильность и сроки годности» рекомендуется устанавливать только следующие режимы хранения:
- от +2 до +25 градусов (или +30 в зависимости от климатической зоны) с возможными дополнительными указаниями не хранить в холодильнике или не замораживать,
- от +2 до +8 градусов,
- ниже нуля с указанием конкретного диапазона.
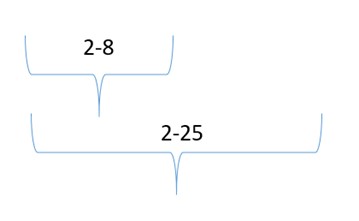
В Европейском союзе данные условия очень четко отражены в декларации по условиям хранения[3]. Во-первых, нужно обратить внимание на отсутствие режимов хранения от +15 до +25 и от +8 до +15 градусов, а во-вторых – на то, что режимы от +2 до +25 и от +2 до +8 градусов при необходимости (например, во время транспортировки) можно объединить в один (от +2 до +8 градусов). Так как ассортимент аптечных товаров очень большой, такая возможность группировки сборных грузов крайне важна для дистрибуции.
Рассмотрим данные аспекты более подробно.
Режим хранения от +15 до +25 градусов
Подавляющее большинство ЛС на рынке РФ имеют режим хранения от +15 до +25 градусов. Вероятно, данный режим пришел из США, в фармакопее которых говорится о том, что для ЛС с таким режимом допускается хранение при более низких температурных режимах (от +2 до +8 и от +8 до +15 градусов), если производителем (держателем РУ) не дано дополнительных указаний. Это означает, что основное внимание должно быть направлено на контроль верхней границы (+25 градусов), а за выход ниже +15 градусов (но не ниже +2) можно не так сильно беспокоиться. Как правило, это обусловливается уравнением Аррениуса, согласно которому повышение температуры увеличивает константу скорости химической реакции.
Но нужно понимать, что из этого правила есть и исключение: в зависимости от лекарственной формы и свойств лекарственного средства может возникнуть опасность снижения качества вследствие физических изменений при воздействии низких температур. Также нижний предел важен, потому что может оказать негативное влияние на упаковку. Именно поэтому допускается, что производитель все-таки может установить запрет на хранение при более низких температурных условиях.
В фармакопее РФ ремарка по поводу допуска хранения при более низких температурах отсутствует, а на рынке РФ существует множество препаратов, зарегистрированных с режимом хранения от +15 до +25 градусов. Одновременно те же самые препараты на территории ЕС зарегистрированы с режимом хранения от +2 до +25. Исходя из этого, можно сделать вывод, что дистрибуция на территории РФ существенно сложнее, чем в ЕС. Такое мнение подкрепляется еще и тем, что в ОФС 1.1.0010.18 «Хранение лекарственных средств» режим, который не требует специальных условий хранения, обозначен как от +15 до +25 градусов. Но чтобы поддерживать режим от +15 градусов, все-таки нужны соответствующие ресурсы. Учитывая, что в настоящий момент судебная практика такова, что нарушением считается любое минимальное отклонение от заявленного режима, а на каждого из участников цепи поставок накладывается суровое бремя доказывания соблюдения температуры, то при приемке товара субъекты контролируют друг друга и строго проверяют наличие нарушений заявленного режима хранения. Поэтому достаточно легко представить ситуацию, когда из обращения могут изыматься препараты, качество которых в действительности не пострадало в виду очень буквального восприятия заявленных границ.
Режим от +8 до +15 градусов
Данный режим, как и режим от +15 до +25 градусов, в теории может допускать хранение при более низкой температуре (от +2 до +8). Такая возможность отражена и в фармакопее РФ.

Тем не менее применение режима пониженной температуры влечет за собой большой регуляторный риск, ведь согласно Приказу Министерства здравоохранения РФ от 31 августа 2016 года № 646н «Об утверждении Правил надлежащей практики хранения и перевозки лекарственных препаратов для медицинского применения» условия хранения должны соответствовать тем условиям, которые указаны на упаковке, в нормативной документации, составляющей регистрационное досье лекарственного препарата, а также в инструкции по медицинскому применению.
Данная формулировка не предусматривает возможности хранения ЛС в каком-либо альтернативном заявленному режиме. Режим хранения от +8 до +15 градусов является неудобным, так как редко может быть обеспечен в домашних условиях у конечного потребителя. Также на данный режим не ориентированы производители пассивных термоконтейнеров, поэтому обеспечение такого режима весьма ресурсозатратно.
Автору этой статьи не удалось найти препараты с режимом хранения от +8 до +15 градусов, зарегистрированные для обращения на территории США или ЕС, поэтому можно предположить, что данный режим обращения обширно применяется только на территории РФ и стран СНГ.
Требования по обеспечению влажности и защиты от света
Де-юре, если производитель заявляет какие-либо условия хранения, то их необходимо исполнять без размышлений о возможности допущения любых отклонений. Но на рынке можно найти ЛС с условиями хранения, которые на практике невозможно обеспечить. Например, можно встретить препараты, на упаковки которых нанесена маркировка «хранить в сухом холодном месте», что согласно ОФС 1.1.0010.18 «Хранение лекарственных средств» означает необходимость хранить при температуре от +2 до +8 градусов и не выше 50% абсолютной влажности. В таких случаях нарушения могут возникнуть уже на этапе производства, но обращают внимание на них, как правило, за пределами завода на последующих этапах обращения. Среди специалистов фармотрасли многократно обсуждалось, что на практике в холодных помещениях всегда высокая влажность.Такая зависимость подтверждается I—d-диаграммой влажного воздуха, впервые составленной в 1918 году советским инженером-теплотехником Леонидом Рамзиным. Также необходимо обратить внимание на то, что в требованиях по изучению стабильности для режима хранения от +2 до +8 градусов отсутствует параметр контроля за влажностью.
Руководство по изучению стабильности ЛС предписывает, чтобы защиту продукта от порчи обеспечивала упаковка и что указания в маркировке специальных условий хранения не следует использовать для компенсации неправильно выбранной упаковки. Маркировка «хранить в сухом месте» лишний раз подчеркивает важность этих условий, и ее следует воспринимать как «хранить в оригинальной упаковке[4]». То же самое касается и защиты от света.
Другие (нестандартные) режимы хранения
На рынке также встречаются и препараты с более строгими и нестандартными условиями хранения (например, от +1 до +5, от +12 до +15, от +18 до +22, от +15 до +20 градусов и другие). Для их соблюдения требуются дополнительные ресурсы, так как очень трудно обойтись без выделения под них соответствующих отдельных мест или зон хранения. Так же, как и для режима от +8 до +15 градусов – как правило, это препараты, предназначенные для обращения на российском рынке.

К сожалению, возникают ситуации, когда дистрибьютор не может обеспечить заявленный режим хранения и вынужден от отказаться от товаров с таким режимом, поэтому на стадии изучения требований по стабильности и регистрации следуют думать, имеются ли необходимые возможности для обеспечения такого режима на всей цепи поставки. Подавляющее большинство препаратов с нестандартными режимами хранения имеют аналоги других производителей, для которых установлены стандартные режимы хранения, что делает их более удобными для дистрибуции.
Итоги
В 2019 году компания АО НПК «Катрен» обращалась к производителям препаратов, имеющим нестандартные условия хранения и режим хранения от +8 до +15 градусов на предмет возможности изменения условий хранения. Несмотря на трудности по внесению изменений в регистрационное досье, ряд производителей с пониманием отнеслись к таким запросам. Ведь данные изменения позволяют повысить доступность их препаратов, а тем самым и конкурентоспособность, что важно в том числе и для импортозамещения. За счет такого взаимодействия нам удалось существенно снизить в своем ассортименте количество позиций с «неудобными» режимами хранения.
Однако назвать такое взаимодействие простым нельзя. Одна из причин заключается в трудностях коммуникации: не всегда удается передать информацию именно в те отделы, которые действительно могут ее обработать, проанализировать, поднять данные о стабильности и так далее. Данные о стабильности бывают труднодоступны, а сотрудники, контактирующие с дистрибьютором, ограничены во времени и не мотивированы на решение подобных задач. Хотелось бы, чтобы механизм взаимодействия между субъектами относительно данных о стабильности и режимах хранения был отточен и регламентирован по аналогии взаимодействия при осуществлении фармаконадзора, когда никакие отлагательства не допускаются.
Современные тенденции показывают, что для проведения расследований температурных отклонений необходимо взаимодействие между производителем и остальными субъектами обращения ЛС, и ситуации, требующие совместного участия, в ближайшем будущем будет возникать все чаще и чаще.
Ссылки
[1] ОФС.1.1.0009.18 «Стабильность и сроки годности» (эквивалент ICH Q1A(R2) Guideline Stability Testing of New Drug Substances and Products, 2003 год).
[2] Решение Совета Евразийской экономической комиссии от 3 ноября 2016 года № 80 «Об утверждении Правил надлежащей дистрибьюторской практики в рамках Евразийского экономического союза»;
Приказ Министерства здравоохранения РФ от 31 августа 2016 года № 646н «Об утверждении Правил надлежащей практики хранения и перевозки лекарственных препаратов для медицинского применения»;
Общая фармакопейная статья ОФС 1.1.0010.18 «Хранение лекарственных средств».
[3] Guideline on declaration of storage conditions, 2007 год.
[4] Или конкретной упаковке, указанной производителем. Например, во флаконе, блистере и т.п.
Источник: GDP REVIEW 2 — Сборник практических статей III Международной конференции Логистика лекарственных средств
