
Согласно ОФС.1.1.0025.18 «Упаковка, маркировка и транспортирование лекарственных средств» [1], упаковка лекарственного средства должна быть надлежащего качества. Маркировка, нанесенная на упаковку, должна обеспечить идентификацию лекарственного средства и предоставить установленный нормативными документами объем информации о лекарственном средстве потребителю и специалистам, осуществляющим с ним работу. Печатные упаковочные материалы считаются критическими для обеспечения соответствия лекарственного средства установленным требованиям, поэтому в соответствии с требованиями надлежащей производственной практики (Good Manufacturing Practice, GMP) им следует уделять особое внимание. Они должны закупаться у одобренных поставщиков, проходящих аудит. Согласно п. 8.4. стандарта ISO 9001:2015 «Системы менеджмента качества — требования» (Quality management systems — Requirements) [2], организация должна определить и применять критерии оценки, выбора, мониторинга результатов деятельности, а также повторной оценки внешних поставщиков, исходя из их способности выполнять процессы или поставлять продукцию и услуги в соответствии с требованиями. Организация должна регистрировать и сохранять документированную информацию об этих действиях и о любых необходимых действиях, вытекающих из оценок. Эта статья посвящена аудиту поставщиков печатных вторичных упаковочных материалов.
Термины и определения
Упаковочный материал (packaging material) — это любой материал, используемый при упаковке лекарственного средства, кроме любой транспортной тары для транспортирования или отгрузки. Упаковочные материалы относятся к первичным или вторичным в зависимости от того, предназначены они для непосредственного контакта с лекарственным средством или нет [3].
Первичные упаковочные материалы (primary packaging materials) — это материалы, используемые в фармацевтической упаковке, которая будет содержать, герметизировать или использоваться для дозированного применения лекарственного средства и которая будет находиться в непосредственном контакте с лекарственным средством [4].
Вторичные упаковочные материалы (secondary packaging materials) — это упаковочные материалы, не вступающие в контакт с лекарственным средством. Например: картонные коробки с текстом и без текста, этикетки, инструкции или листки-вкладыши (или рекламные листки), обертки и контейнеры для транзитных перевозок, например, складные коробки [4].
Маркировка может наноситься и на первичные, и на вторичные упаковочные материалы. Печатные упаковочные материалы содержат информацию о конкретном препарате, поэтому любые ошибки могут иметь далеко идущие последствия.
Требования к печатным упаковочным материалам
Согласно определениям в руководствах по GMP, упаковочные материалы не являются исходным сырьем, однако применяемые при обращении с исходным сырьем требования также должны применяться при обращении с некоторыми упаковочными материалами.
В соответствии с п. 5.45. Правил GMP ЕАЭС, утвержденных Решением Совета ЕЭК от 03.11.2016 г. № 77 [3], закупке и контролю первичных и печатных упаковочных материалов, а также обращению с ними следует уделять такое же внимание, как и исходным материалам.
Тот же самый пункт в тексте EU GMP [5] изложен более полно: выбору, квалификации, утверждению и поддержанию статуса поставщиков первичных и печатных упаковочных материалов следует уделять такое же внимание, как и исходному сырью. То есть в рамках фармацевтической системы качества для печатных упаковочных материалов должны быть задокументированы не только закупка и приемка.
Для каждого утвержденного поставщика или материала должны быть в наличии подтверждающие свидетельства. Персоналу, вовлеченному в эту деятельность, необходимо иметь актуальные знания о поставщиках, цепях поставок и связанных с ними рисках.
В соответствии с п. 5 Приложения 8 к руководствам по GMP [3, 6], в плане по отбору проб упаковочных материалов должны быть также учтены сведения о системе обеспечения качества производителя упаковочных материалов, основанные на результатах проведения аудитов.
Не случайно в памятной записке PIC/S PI 028-2 «GMP инспекция, связанная с упаковкой» (GMP inspection related to packaging) [7] первыми значатся вопросы, связанные с качеством и закупками упаковочных материалов, в частности с их закупками у одобренных поставщиков, а также с аудитом производственных площадок поставщиков первичных упаковочных материалов для стерильной продукции и печатных материалов («Какова политика утверждения поставщиков?», «Покажите мне аудиторский отчет»).
Поиск потенциальных поставщиков печатных упаковочных материалов
Поиск поставщиков печатных упаковочных материалов должен начинаться с анализа рынка этих поставщиков. Уровень контроля должен быть пропорционален рискам, связанным с конкретными материалами, с учетом источника их происхождения, производственного процесса, сложности цепи поставок и конечного назначения материала в лекарственном средстве.
Используя системный подход к управлению рисками для качества, на этапе поиска потенциальных поставщиков необходимо провести общую оценку рисков, связанных с упаковочными материалами и определить уровень риска, касающийся печатных упаковочных материалов.
Материалы для упаковки лекарственных средств можно разделить на следующие категории:
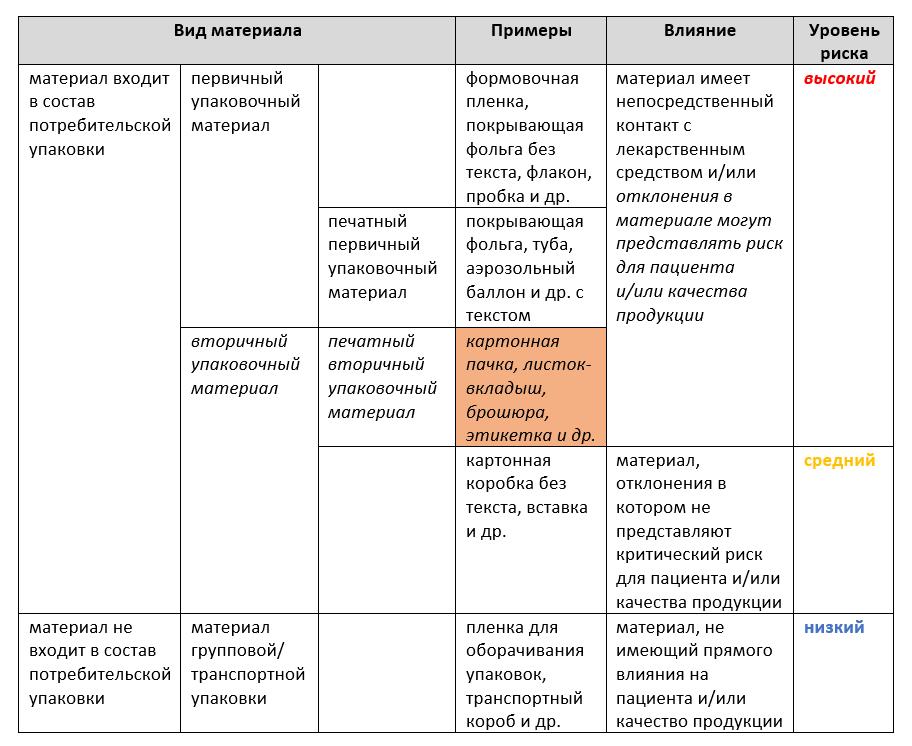
Выбор потенциальных поставщиков печатных упаковочных материалов
На этапе предварительного выбора поставщиков печатных упаковочных материалов собирается необходимая информация о надежности цепи поставки, наличии системы менеджмента качества, возможности сотрудничества и т. д.
В учебнике для студентов вузов «Управление закупками и поставками» [8] приводятся общие критерии, которые применяется при предварительном выборе потенциальных поставщиков: качество продукции, своевременность доставки, цена, обслуживание, повторные предложения по разработке продукции или услуги по снижению цены, техническая, инженерная и производственная мощности, оценка дистрибьюторских возможностей, детальная оценка финансов и управления.
Авторами монографии «Разработка модели комплексных аудитов фармацевтической системы качества» [9] была разработана унифицированная стандартная процедура предварительного выбора поставщиков исходного сырья и упаковочных материалов.
Одним из этапов данной процедуры является определение основных критериев отбора для проведения предварительной оценки потенциальных поставщиков. У потенциального поставщика запрашивается требуемая информация и проводится оценка полученных документов на наличие, полноту, достоверность и соответствие законодательству. По мнению авторов монографии перечень основных критериев для поставщиков упаковочных материалов должен включать в себя:
- прослеживаемая цепь поставки (надежность поставки);
- сертификаты (например, ISO, HACCP);
- организационные схемы производства;
- история проведения внешних и внутренних аудитов (самоинспекций);
- информация по претензиям, отзыву и изъятию;
- мощность и продолжительность производства;
- стабильность организации;
- стоимость;
- репутация и роль в своей отрасли;
- гарантии качества.
Поставщики, которые не удовлетворяют выбранным критериям, считаются отклоненными.
Такой подход дает возможность отобрать или отклонить поставщиков упаковочных материалов на начальном этапе. Аудит проводится уже у предварительно выбранных поставщиков.
Анализ и оценка потенциальных поставщиков печатных упаковочных материалов
В статье «Заочный аудит поставщика — проблемы, риски, возможности» [10] руководитель группы компаний ВИАЛЕК Александр Александров предлагает условно разделить всех поставщиков на три категории — поставщики критических позиций, поставщики важных позиций и другие поставщики, и установить подходящую (для каждого из них) модель квалификации и одобрения, исходя из способности заказчика удерживать под контролем риски для качества. Тогда для одобрения одних поставщиков потребуется аудит, для других — решение может приниматься уже после изучения доступной о них информации, текста предоставленного руководства по качеству, мастер-файла и (или) путем признания сертификатов, подтверждающих соответствие деятельности поставщика требованиям тех или иных стандартов.
Высокий уровень критичности печатных упаковочных материалов говорит о необходимости уделять им особое внимание, что требует максимального числа действий при проведении анализа и оценки поставщиков этих материалов. К этим действиям можно отнести:
- анкетирование;
- тестирование образцов;
- проведение аудита.
Анкетирование
Для квалификации поставщиков печатных упаковочных материалов должна быть составлена анкета (вопросник), содержащая список контрольных вопросов.
«Стандартную» анкету необходимо адаптировать под категорию поставщиков упаковочных материалов, исходя из уровня предъявляемых к ним требований. При необходимости, в анкету могут быть всегда внесены дополнения.
Обычно основные реквизиты в анкете включают в себя наименование поставщика и его адрес, виды деятельности, наименование поставляемого материала, лицо, ответственное за качество/заполнившее анкету, подпись и дату заполнения анкеты.
Вопросы в анкете могут касаться персонала, помещений, деятельности по хранению, производству, обеспечению и контролю качества, техническому обслуживанию и инженерному обеспечению и пр.
Тестирование образцов
У поставщиков печатных упаковочных материалов запрашиваются тестовые образцы продукции для проведения контроля качества. Упаковочные материалы, использующиеся при автоматизированной упаковке продукции, тестируются на оборудовании.
Требования к качеству должны быть обсуждены и согласованы с поставщиками. Соответствующие аспекты испытаний и контроля должны быть зафиксированы в спецификациях. Образцы для тестирования должны соответствовать требованиям, указанным в спецификациях.
Качество бумаги и картона, используемых в производстве упаковки для лекарственных средств, должно соответствовать требованиям действующих стандартов, а показатели качества упаковки, выполненной с использованием этих материалов, должно соответствовать документации на этот вид и тип упаковки, утвержденной в установленном порядке.
Проведение аудита
Как правило, первичный аудит поставщиков печатных упаковочных материалов должен иметь выездной (on-site) или, в случае ограничений, дистанционный (distant/remote/virtual) формат.
Оценка по документам (desktop, paper-based) плохо подходит для первичной проверки, так как она не включает в себя возможность взять интервью у профильных экспертов (Subject Metter Experts, SMEs), тур по площадке и видеоконференции. Такая проверка не позволит получить детальную информацию о поставщике по многим аспектам, в результате чего может быть недостаточно данных для принятия решения по одобрению поставщика. Тем не менее оценка по документам может быть выполнена при повторном аудите (при проверке, выполняемой после устранения выявленных серьезных недостатков) или при рутинном аудите (при проверке, выполняемой у уже одобренного поставщика в соответствии с утвержденным планом проверок).
Цель проведения аудита — подтвердить, что поставляемые материалы производятся в надлежащих условиях и соответствуют требованиям стандартов оценки.
Исходя из уровня требований, предъявляемых к вторичным упаковочным материалам, одним из основных стандартов оценки поставщиков печатных вторичных упаковочных материалов является стандарт ISO 9001:2015 [2]. Этот стандарт нацелен на продвижение применения процессного подхода для разработки, внедрения и улучшения результативности системы менеджмента качества, роста удовлетворенности потребителя посредством выполнения его требований.
Помимо этого международного стандарта, для проведения оценки могут использоваться другие стандарты и руководства.
«Руководство для индустрии: Гонконгское руководство по GMP для вторичной упаковки фармацевтической продукции» (Guidance for Industry: Hong Kong Guide to GMP for the Secondary Packaging of Pharmaceutical Products) [11] было издано Управлением по лекарственным средствам Министерства здравоохранения Гонкога.
В п. 5.13 данного руководства, посвященном одобрению поставщиков упаковочных материалов, говорится о том, что перепутывание или другие ошибки, связанные с текстом, можно свести к минимуму, приобретая этикетки и печатные упаковочные материалы у проверенных и одобренных поставщиков (полиграфических компаний). Объем выполнения оценки, необходимый для одобрения поставщика, зависит от уровня риска, связанного с поставляемой им печатной продукцией. Доступны различные методы оценки, такие как выездной аудит, подтверждение соответствия стандарту серии ISO 9000, заполнение анкеты и т. д.
Поставщики критических печатных упаковочных материалов должны быть одобрены выездным аудитом, этот аудит должен быть задокументирован. Как минимум, аудит должен установить, что поставщики отвечают следующим требованиям:
- Должны иметься подходящие помещения с достаточным пространством и разделением, чтобы свести к минимуму вероятность перепутывания.
- Должны иметься письменные процедуры для печати фармацевтических упаковочных материалов и вестись записи по каждой напечатанной партии. Процедуры должны включать проверку очистки линии (line clearance) перед началом печати, а также инструкции по контролю запуска, повреждениям, отбраковке, образцам для контроля качества и излишкам печатных материалов.
- Должны проводиться проверки контроля качества в начале, во время и в конце каждого тиража. Эти проверки должны быть зарегистрированы. Образцы, отобранные для проверки, не должны возвращаться в партию и должны быть уничтожены. Образец всех печатных материалов, связанных с конкретной партией, должен быть приложены к документации на партию.
- Должен осуществляться контроль спецификаций, чтобы быть уверенным в том, что используется только правильная спецификация.
- Должен осуществляться контроль печатных форм (если применимо), чтобы быть уверенным в их правильности перед использованием и в том, что лишние формы уничтожены или приведены в негодность, чтобы предотвратить их использование в будущем.
- Каждая партия печатного упаковочного материала должна быть надежно упакована, иметь надлежащую маркировку и получить уникальный номер партии для прослеживаемости.
- Излишки этикеток должны быть уничтожены или отправлены заказчику. Нельзя оставлять излишки печатных упаковочных материалов для включения в следующую партию.
- До доставки заказчику печатные упаковочные материалы должны храниться в безопасном помещении с ограниченным доступом.
Отчет по проведению аудита должен полностью отражать все, что было сделано, и должны быть четко определены любые обнаруженные в результате аудита недостатки. Должны быть осуществлены все необходимые корректирующие и предупреждающие действия (САРА).
В декабре 2022 года на онлайн-семинаре «Упаковка вашего успеха» исполнительный директор АО «ПРОМИС» Валентина Слепнева рассказала о том, как проводить аудит полиграфической компании в текущих условиях. Ее презентация называлась «Подводные камни» аудита полиграфической компании».
В частности, Валентина перечислила следующие «отраслевые» стандарты для полиграфии:
- ISO 12646:2015 «Технология полиграфии. Дисплеи для получения цветных пробных изображений. Характеристики и условия для контроля» (Graphic technology — Displays for colour proofing — Characteristics) [12]
- ISO 12647-2:2013 «Технология полиграфии. Управление технологическим процессом по изготовлению растровых цветоделенных изображений, пробных и тиражных оттисков. Часть 2: Процессы офсетной печати» (Graphic technology — Process control for the production of half-tone colour separations, proof and production prints — Part 2: Offset lithographic processes) [13]
- ISO 12647-7:2016 «Технология полиграфии. Управление технологическим процессом по изготовлению растровых цветоделенных изображений, пробных и тиражных оттисков. Часть Получение пробных оттисков непосредственно по цифровым данным» (Graphic technology — Process control for the production of halftone colour separations, proof and production prints — Part 7: Proofing processes working directly from digital data) [14]
- ISO 3664:2009 «Технология полиграфии и фотография. Условия просмотра. Требования к освещенности» (Graphic technology and photography — Viewing conditions) [15]
- ISO 2846-1:2017 «Технология полиграфии. Цвет и прозрачность красок для четырехкрасочной печати. Часть Листовая и рулонная офсетная печать» (Graphic technology — Colour and transparency of printing ink sets for four-colour printing — Part 1: Sheet-fed and heat-set web offset lithographic printing) [16].
По итогам проведенного анализа и оценки поставщика упаковочного материала и его продукции принимается решение о статусе этого поставщика — например, «одобренный поставщик», «отклоненный поставщик/поставщик не одобрен», «временно/условно одобренный поставщик».
Если проведение аудита является частью процедуры квалификации поставщика и потенциальный поставщик не планирует разработку и выполнение плана САРА, то в этом случае поставщик считается не одобренным для дальнейшей работы с ним. Одобренные поставщики вносятся в реестр одобренных поставщиков.
Диалог с экспертом

Валентина Слепнева любезно ответила на несколько вопросов, касающихся аудита поставщиков печатных вторичных упаковочных материалов.
Валентина, насколько я знаю, Вы сами являетесь СЕРТИФИЦИРОВАННЫМ АУДИТОРОМ –аудитором IRCA (Международного Регистра Сертифицированных Аудиторов) по системам менеджмента качества. Помогает ли это Вам эффективнее готовиться к сертификационным и надзорным аудитам?
— Безусловно помогает, Константин. В первую очередь, помогает добиться понимания аудиторов второй стороны в части разъяснения реализации требований стандарта ISO 9001:2015. Поскольку основная доля наших Заказчиков — это фармацевтические компании, то и акцент в рамках проведения аудита второй стороны они стараются делать на требованиях стандарта GMP, а не ISO 9001:2015, а для производителя вторичных упаковочных материалов стандарт GMP в «чистом» виде применить далеко не всегда возможно.
В соответствии с п. 5.5.4 стандарта ISO 19011:2018 «Руководящие указания по аудиту систем менеджмента» (Guidelines for auditing management systems) [17], группа по аудиту должна быть сформирована с учетом компетентности, необходимой для достижения целей конкретного аудита в рамках установленной области аудита. По Вашему мнению, можно ли эффективно провести аудит полиграфической компании без включения в команду аудиторов ТЕХНИЧЕСКИХ ЭКСПЕРТОВ, имеющих знания в области применимых стандартов оценки?
— С моей точки зрения, без специальных знаний или присутствия технического эксперта эффективно провести аудит полиграфической компании невозможно. Наглядным примером служит присвоение профессионального кода экспертам Органом по сертификации, для достижения более валидных результатов аудита и приобретения добавленной стоимости компанией, в которой проводится аудит. Согласитесь, мало интересно, когда в полиграфической компании проверяется в основном управление документацией и записями и мероприятия по дератизации.
На какие НАИБОЛЕЕ ВАЖНЫЕ специфические моменты нужно обращать внимание во время аудита полиграфической компании?
— Наиболее важные моменты:
- управление процессами допечатной подготовки;
- производство и/или инструментальный контроль смесевых печатных красок;
- инструментальный входной контроль материалов;
- управление цветом на всех этапах жизненного цикла продукта;
- операционный и выходной контроль качества.
Стандарт ISO 15378:2017 «Первичные упаковочные материалы для лекарственных средств. Особые требования по применению ИСО 9001:2015 с учетом надлежащей производственной практики (GMP)» (Primary packaging materials for medicinal products — Particular requirements for the application of ISO 9001:2015, with reference to good manufacturing practice (GMP) [4] устанавливает требования к системе менеджмента качества, применимой к первичным упаковочным материалам для лекарственных средств. Этот стандарт включает Приложение С «Требования GMP к печатным первичным упаковочным материалам». Как Вы считаете, насколько применимы требования данного Приложения к ПЕЧАТНЫМ ВТОРИЧНЫМ упаковочным материалам?
— В полном объеме для вторичных полиграфических материалов его применить сложно, на мой взгляд. Например, раздел C.1.2 Matched plates/cylinders: офсетные формы всегда изготавливаются и применяются комплектом на тираж, количество форм зависит от количества красок в макете. Более того, в зависимости от подложки (от материала, на котором производится печать) их может быть изготовлено более одного комплекта. В среднем на 30 тысяч штук листов — 1 комплект форм. И формы вещь одноразовая!
Многие из озвученных Вами на онлайн-семинаре моментов непросты для понимания даже опытного аудитора. Один из главных помощников аудитора — это вопросник, который высылается аудируемому предприятию заранее, используется при подготовке плана аудита и во время аудита. Как Вы думаете, можно ли трансформировать представленную Вами информацию (важные специфические моменты, на которые нужно обращать внимание во время аудита полиграфической компании) в виде конкретных ВОПРОСОВ, которые аудитор может/должен включить в свой вопросник?
[вопрос был задан в рамках онлайн-семинара «Упаковка вашего успеха»]
— Конечно, даже самый продвинутый аудитор по стандарту GMP или ISO или иное, не имеет специальных знаний по полиграфии. Обычно специальные вопросы в зоне ответственности технического эксперта/консультанта. Безусловно можно подготовить перечень контрольных вопросов к аудиту, если требуется, мы можем запланировать их подготовку.
Пример анкеты для поставщиков печатных упаковочных материалов
Выбор, квалификация, утверждение и поддержание статуса поставщиков печатных упаковочных материалов является обязательным требованием. Производители лекарственных средств должны выполнять программу оценки таких поставщиков (включающую проведение аудита), соблюдать периодичность оценки, проводить анализ качества поступающих материалов и следовать процедуре одобрения поставщиков. Представленный материал подготовлен с использованием данных, актуальных на 13.03.2023. В случае получения новых или дополнительных данных статья может быть обновлена.
ССЫЛКИ:
- Государственная фармакопея РФ XIV изд. Том I. ОФС.1.1.0025.18 «Упаковка, маркировка и транспортирование лекарственных средств». URL: https://femb.ru/record/pharmacopea14 (дата обращения 13.03.2023)
- ISO / ISO 9001:2015 Quality management systems — Requirements. URL: https://www.iso.org/standard/62085.html (дата обращения 13.03.2023)
- Евразийский экономический союз / Решение Совета Евразийской экономической комиссии от 03.11.2016 г. № 77 «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза». URL: https://docs.eaeunion.org/docs/ru-ru/01411921/cncd_21112016_77 (дата обращения 13.03.2023)
- ISO / ISO 15378:2017 Primary packaging materials for medicinal products — Particular requirements for the application of ISO 9001:2015, with reference to good manufacturing practice (GMP). URL: https://www.iso.org/standard/70729.html (дата обращения 13.03.2023)
- The rules governing medicinal products in the European Union — Volume 4 — EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use / Chapter 5: Production. URL: https://health.ec.europa.eu/system/files/2016-11/chapter_5_0.pdf (дата обращения 13.03.2023)
- The rules governing medicinal products in the European Union — Volume 4 — EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use / Annex 8: Sampling of Starting and Packaging Materials. URL: https://health.ec.europa.eu/system/files/2016-11/anx08_enpdf (дата обращения 13.03.2023)
- Pharmaceutical Inspection Co-operation Scheme / PIC/S GMP Inspection Related to Packaging (PI 028-2). URL: https://picscheme.org/docview/3822 (дата обращения 13.03.2023)
- Линдерс М., Джонсон Ф., Флинн А., Фирон Г. «Управление закупками и поставками: Учебник для студентов вузов. 13 -е изд.» — М.: Юнити-Дана, 2007. — 751 с. ISBN 978-5-238-01235-3
- Пятигорская Н.В., Николенко Н.С., Береговых В.В., Ишмухаметов А.А. «Разработка модели комплексных аудитов фармацевтической системы качества» — М.: Российская академия наук, 2020. — 398 с.: 26 ил. ISBN 978-5-907036-86-4
- Александров А. «Заочный аудит поставщика — проблемы, риски, возможности». URL: https://teletype.in/@vialek/SqywDBEt_ (дата обращения 13.03.2023)
- The Drug Office of the Hong Kong Special Administrative Region / Guidance for Industry: Hong Kong Guide to GMP for the Secondary Packaging of Pharmaceutical Products. URL: https://www.drugoffice.gov.hk/eps/do/tc/doc/guidelines_forms/Guidance_for_Industry_eng.pdf (дата обращения 13.03.2023)
- ISO / ISO 12646:2015 Graphic technology — Displays for colour proofing – Characteristics. URL: https://www.iso.org/standard/57311.html (дата обращения 13.03.2023)
- ISO / ISO 12647-2:2013 Graphic technology — Process control for the production of half-tone colour separations, proof and production prints — Part 2: Offset lithographic processes. URL: https://www.iso.org/standard/57833.html (дата обращения 13.03.2023)
- ISO / ISO 12647-7:2016 Graphic technology — Process control for the production of halftone colour separations, proof and production prints — Part 7: Proofing processes working directly from digital data. URL: https://www.iso.org/standard/66426.html (дата обращения 13.03.2023)
- ISO / ISO 3664:2009 Graphic technology and photography — Viewing conditions. URL: https://www.iso.org/standard/43234.html (дата обращения 13.03.2023)
- ISO / ISO 2846-1:2017 Graphic technology — Colour and transparency of printing ink sets for four-colour printing — Part 1: Sheet-fed and heat-set web offset lithographic printing. URL: https://www.iso.org/standard/70905.html (дата обращения 13.03.2023)
- ISO / ISO 19011:2018 Guidelines for auditing management systems. URL: https://www.iso.org/standard/70017.html (дата обращения 03.2023)


