При разработке системы качества, соответствующей правилам GDP, необходимо создать процедуру управления отклонениями. В данной процедуре необходимо описать: порядок фиксации отклонений, алгоритм их постановки на учет (регистрации), классификацию отклонений, схему принятия решения о необходимости проведения расследования, порядок разработки корректирующих и/или предупреждающих действий (САРА) и оценки их эффективности.
Согласно пункта 1.2 правил GDP система качества должна гарантировать, что:
- отклонения от установленных процедур документально оформляются и в их отношении проводятся расследования;
- необходимые корректирующие и предупреждающие действия предпринимаются для устранения отклонений и предупреждения их появления в соответствии с принципами управления рисками для качества.

Система управления отклонениями может быть электронной или бумажной. При этом независимо от используемой системы, все этапы управления отклонениями должны выполняться.
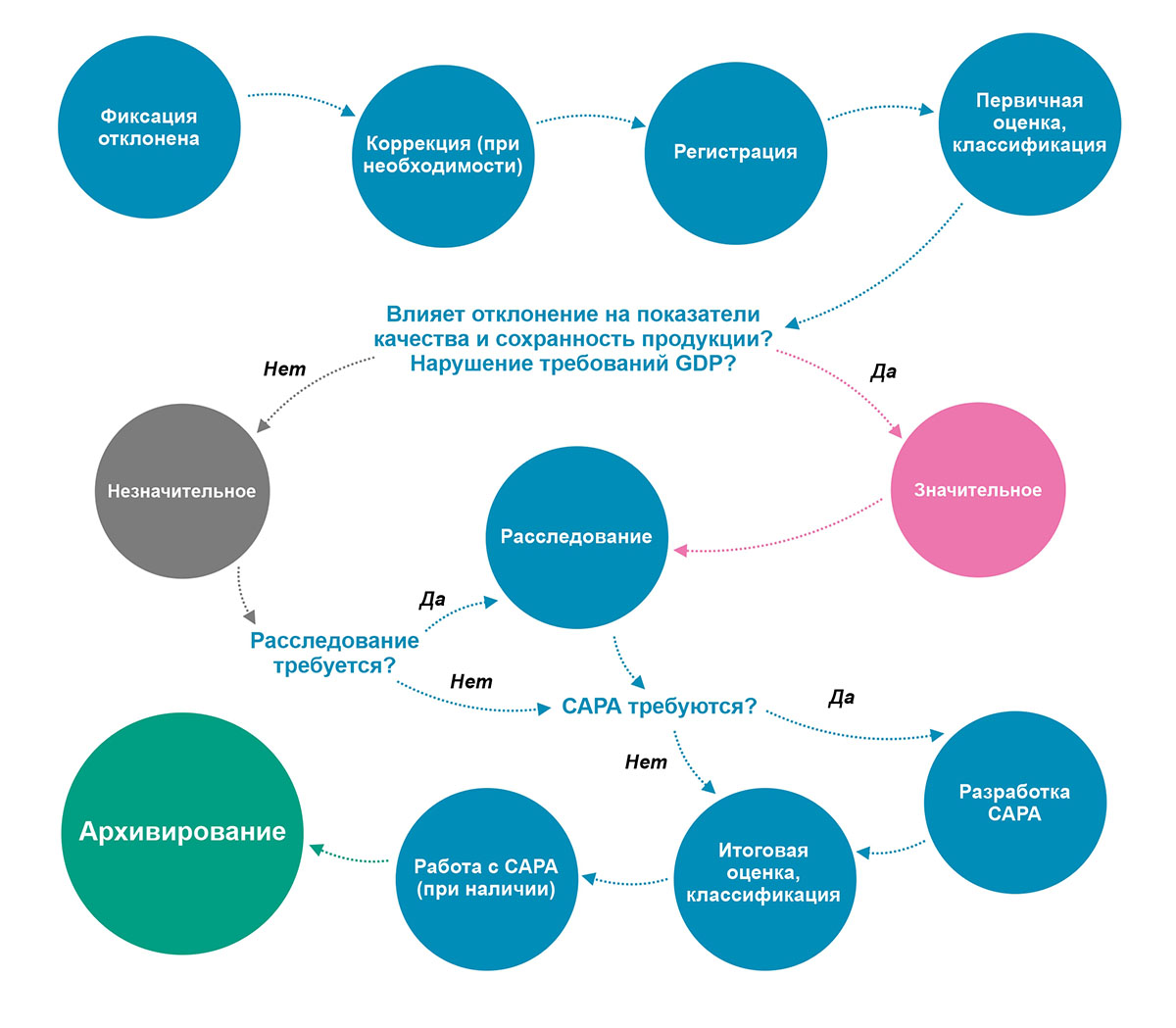
Алгоритм работы с отклонениями приведен на блок-схеме. Для разработки системы управления отклонениями необходимо установить ответственных за каждый этап. Сразу после выявления могут потребоваться коррекции – меры, направленные на устранение отклонения (отвечающие на вопрос «Что нужно сделать сейчас чтобы исправить ситуацию?»). Сотрудник, выявивший отклонение, выполняет коррекции самостоятельно или с привлечением сотрудников соответствующих подразделений. Например, при выявлении отклонения в климатических параметрах на складе, сотрудник сообщает об этом специалисту по вентиляции для устранения отклонения.
После принятия соответствующих мер (если они возможны), отклонение необходимо зарегистрировать в журнале (валидированном электронном или бумажном). При регистрации каждому отклонению присваивается номер. Порядок постановки на учет должен быть описан в процедуре управления отклонениями.
Как видно на блок-схеме, отклонения классифицируются следующим образом:
- значительное (существенное) отклонение – отклонение, влияющее на показатели качества или сохранность лекарственного средства, отклонение от правил GDP;
- незначительное (несущественное) отклонение – отклонение, не влияющее на показатели качества или сохранность лекарственного средства.
Обратите внимание, что в правилах GDP нет классификации отклонений, в отличие от правил GMP, где встречаются «отклонения» и «существенные (значительные) отклонения». Классификация может быть расширена: критические, значительные и незначительные (или другие) отклонения. Какую классификацию применять решает непосредственно разработчик системы качества. Исходя из минимальных требований правил GxP, мы будем дальше использовать понятия «значительное» и «незначительное» отклонения.
Для значительных отклонений расследование проводится обязательно, для незначительных – при необходимости. Расследование проводится с целью выявления причины и/или последствий отклонения. Но бывают отклонения, по которым причина сразу установлена или очевидна. В таких случаях расследование не проводится. Т.е. расследование не требуется, если ты знаем, что это за отклонение, понимаем его природу, причину возникновения и последствия.
Например, первый раз выявляется отклонение, которое при первичной оценке классифицируется как значительное. Затем проводится расследование, устанавливается причина, разрабатываются САРА. В качестве САРА устанавливается алгоритм действий при повторном выявлении подобного отклонения. Данный алгоритм описывается в процедурах. Тогда в случае повторного аналогичного отклонения необходимо только проведение коррекции, САРА не требуются.
Если незначительное отклонение повторяется значительное количество раз (значительность определяется ответственным лицом за оценку отклонений), оно может классифицироваться как значительное отклонение.
Блок-схема управления отклонениями
Для управления отклонениями и разработкой САРА очень важно понимать разницу между понятиями «коррекция», «корректирующие действия» и «предупреждающие действия»:
- коррекция — меры, направленные на устранение непосредственно самого отклонения;
- корректирующее действие — действие, предпринятое для устранения причины обнаруженного отклонения или другой нежелательной ситуации;
- предупреждающее действие — действие, предпринятое для устранения причины потенциального отклонения или другой потенциально нежелательной ситуации.
Коррекция отвечает на вопрос «Что необходимо сделать сейчас, чтобы исправить ситуацию?», корректирующие и предупреждающие действия – на вопрос «Что нужно сделать, чтобы впредь такого не было?»
В правилах GDP описаны отклонения, для которых расследование обязательно:
- дистрибьютор отслеживает осуществляемые сделки и проводит расследования в отношении любых отклонений в цепочке реализации наркотических средств, психотропных веществ и других опасных веществ. При выявлении отклонений от прописанной процедуры реализации, которые могут означать использование лекарственных средств не по назначению, должны проводиться расследования (п.71);
- анализ складских запасов должен проводиться регулярно в соответствии с требованиями законодательства. Выявленные отклонения должны быть документально оформлены, и в их отношении должно быть проведено расследование п.81);
- в случае возникновения отклонений таких, как нарушение температурного режима или порча лекарственных средств в процессе транспортировки, информация о них должна быть сообщена отправителю и получателю. Должна быть разработана и документально оформлена процедура, определяющая порядок действий при возникновении отклонений и расследовании данных фактов (п.124);
- отклонения от установленных процедур документально оформляются и в их отношении проводятся расследования (п.11(д)).
В правилах GDP описаны отклонения, для которых расследование необязательно:
- дистрибуция лекарственных средств (отгрузка) должна быть организована таким образом, чтобы лекарственные средства с меньшим сроком годности отгружались в первую очередь (FEFO – frst expire frst out). Отклонения от данного требования должны быть задокументированы (п. 79).
То есть при отступлении от правила FEFO этот факт достаточно задокументировать, и расследование проводить необязательно. Давайте рассмотрим 2 случая.
Первый случай.
На складе имеется остаток серии Х и полная серия (Х+1). По заказу коммерческой службы клиенту необходимо отгрузить полную серию (Х+1), что нарушает принцип FEFO. В таких случаях необходимо оформить отклонение, но проводить расследование и разрабатывать САРА не требуется (причина очевидна, меры по устранению не требуются). Отклонение классифицируется как незначительное.
Второй случай.
Отклонение в соблюдении принципа FEFO выявлено при ежемесячном анализе данных по отгрузкам, т.е. отклонение не было своевременно задокументировано и санкционировано. Необходимо также открыть отклонение. Так как соблюдение принципа FEFO – это прямое требование GDP, то отклонение будет классифицировано как значительное и необходимо проведение расследования, в ходе которого будет устанавливаться причина его возникновения. Например: по результатам расследования подтвержден сбой в компьютеризированной системе. Следовательно, необходимо вырабатывать САРА и устранить
- собственно сбой и причину его возникновения;
- по результатам расследования установлено, что отгрузка проведена по заказу коммерческой службы. Однако отклонение от принципа FEFO не было нигде задокументировано. В данном случае причину необходимо искать в области системы качества: имеют ли сотрудники необходимую подготовку? Описан ли порядок действий сотрудников при необходимости отступления от принципа FEFO в какой-то из процедур? и т.п.
Приведенные примеры показывают, что при одинаковом отклонении «несоблюдение принципа FEFO» могут быть совершенно разные действия и разная классификация отклонения, также как и разные САРА.
При выработке САРА необходимо учитывать риски и затраты на САРА. Если стоимость выполнения САРА значительно превышает риск потерь от отклонения, то необходимо оценить обязательность САРА. При этом необходимо учитывать, что:
- по значительным отклонениям необходимы САРА, которые позволят пусть не устранить, но хотя бы в будущем снизить отклонение до уровня незначительного;
- анализ рисков не может использоваться для отказа от выполнения нормативных требований.
Заключение
САРА требуется не для всех отклонений:
— обязательны для значительных отклонений.
— необязательны:
- для незначительных отклонений;
- для незначительных повторяющихся отклонений, по которым ранее проведено расследование и, возможно, выработаны САРА; для подобных отклонений достаточно проведения коррекций;
- если затраты на устранение незначительных отклонений значительно превышают потери от отклонения.
Источник: сборник статей «GDP REVIEW»,
материал II Международной конференции SCM Pharm: логистика лекарственных средств


