В обзоре представлена информация, связанная с инспектированием производителей лекарственных средств для ветеринарного применения на соответствие требованиям Правил надлежащей производственной практики (Good Manufacturing Practice, GMP), которое проводят специалисты подведомственного Россельхознадзору Федерального государственного бюджетного учреждения «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГБУ «ВГНКИ»).
Результаты инспектирования
Согласно реестру выданных заключений, опубликованному на сайте Россельхознадзора 20.06.2022 г., в первой половине 2022 года иностранным производителям было выдано 3 заключения о соответствии требованиям Правил GMP [1]. Первое из этих заключений было сделано в отношении площадки, расположенной в Испании, а два других — в отношении площадок, расположенных в Корее и Хорватии.
Наибольшее число российских инспекций, по результатам которых за последние 5 лет были приняты решения о выдаче/отказе в выдаче GMP-заключения (23, что составляет 17%), было проведено на производственных площадках, расположенных во Франции.
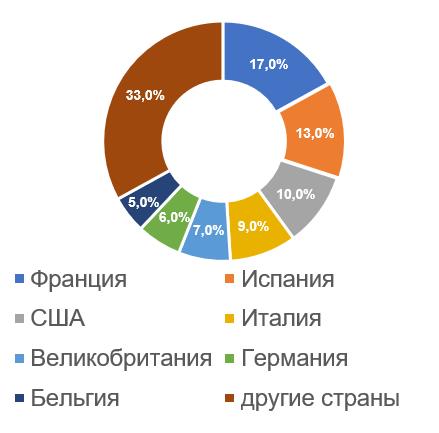
Информация о французских производителях ветеринарных препаратов и их инспектировании на соответствие требованиям Правил GMP представлена здесь: https://pharmprom.ru/francuzskie-proizvoditeli-veterinarnyx-preparatov-i-ix-inspektirovanie/
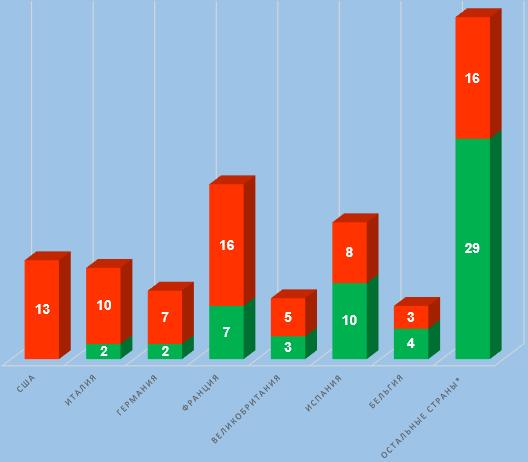
Анализ результатов инспектирования иностранных производителей в тех странах, где было проведено наибольшее число российских инспекций, сейчас показывает те же самые тренды, что и раньше. Производственные площадки, расположенные в Испании и Бельгии, демонстрируют неплохие результаты; производственные площадки, расположенные в США, Италии и Германии, показывают худшие результаты.
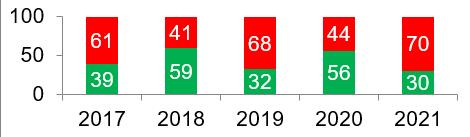
При этом, по имеющимся на сегодняшний день данным о результатах 30 прошлогодних инспекций, в 2021 году процент отказов в выдаче GMP-заключений иностранным производителям стал самым высоким за 5 лет инспектирования. Производителям следует обратить внимание на то, что подготовка к дистанционному инспектированию требует дополнительных усилий со стороны площадки; успешное и своевременное выполнение корректирующих и предупреждающих действий (CAPA-плана) во многом зависит от того, как скоро действия начинают выполняться.
Нужно отметить успехи российских производителей, которые получают все больше и больше заключений. Согласно реестру, в первой половине 2022 года российским производителям было выдано 3 GMP-заключения [1]. Они были получены производственными площадками ООО «Рузфарма», ООО «Агробиоснаб» и ООО «ГОРОС21.РУ».
Об отечественных производителях ветеринарных препаратов, получавших GMP-заключения по результатам проверок, выполненных российским регулятором, можно прочитать здесь: https://pharmprom.ru/rossijskie-gmp-sertificirovannye-proizvoditeli-veterinarnyx-preparatov/
В соответствии с графиком проведения инспектирования, опубликованном на сайте ФГБУ «ВГНКИ» 30.06.2022 г., на вторую половину 2022 года запланировано 36 инспекций производителей ветеринарных препаратов, площадки которых расположены в Австралии, Беларуси, Болгарии, Бразилии, Венгрии, Вьетнаме, Германии, Израиле, Индии, Испании, Италии, Китае, Нидерландах, Новой Зеландии, Сербии, Словакии, США, Финляндии, Франции и Чехии [2]. Некоторые из этих инспекций были изначально запланированы на предыдущие годы, но затем они были перенесены на новые даты. 6 инспекций перенесены на первую половину 2023 года. Больше всего инспекций должно пройти в отношении производственных площадок, расположенных в Испании, Китае, США и Франции.
Прошедшие события и мероприятия
21 января этого года Решением Совета ЕЭК №1 были утверждены Правила регулирования обращения ветеринарных лекарственных средств на таможенной территории Евразийского экономического союза [3]. Утвержденный документ вступит в силу 13 марта 2024 года. Приложение № 26 к нему — «Правила проведения фармацевтических инспекций». Эти Правила будут устанавливать единый порядок проведения фармацевтических инспекций производства ветеринарных лекарственных средств на соответствие требованиям Правил GMP ЕАЭС.
В феврале вступило в силу Решение Совета ЕЭК № 65 от 14.07.2021 г. «О внесении изменений в Правила надлежащей производственной практики Евразийского экономического союза», в котором Приложение № 15 к Правилам GMP ЕАЭС «Квалификация и валидация» изложено уже в новой редакции [4].
ФГБУ «ВГНКИ» был анонсирован cеминар, посвященный изменениям в подходах к квалификации и валидации на предприятии [5].
На какие аспекты производителям нужно обратить более пристальное внимание, недавно рассказывал Александр Белинский (в настоящее время — ведущий специалист по квалификации PQE Group): https://pharmprom.ru/rossijskie-gmp-sertificirovannye-proizvoditeli-veterinarnyx-preparatov/
В первой половине февраля ФГБУ «ВГНКИ» с рабочим визитом посетили Жан-Пьер Оран (Jean-Pierre Orand), директор Французского агентства по ветеринарным лекарственным средствам (Agence Nationale du Médicament Vétérinaire, ANMV) и Мари-Аньес Амос (Marie-Agnès Amos), заместитель советника по сельскому хозяйству, референт по ветеринарным, санитарным и фитосанитарным вопросам по России, Казахстану, Беларуси, Армении, Узбекистану, Таджикистану и Кыргызстану Экономической службы Посольства Франции в России. Во время этого визита заместитель директора ФГБУ «ВГНКИ» Данил Рудняев разъяснил порядок организации и проведения инспектирования производителей лекарственных средств на соответствие требованиям Правил GMP и ответил на вопросы о причинах отказа французским производителям лекарственных средств для ветеринарного применения в выдаче положительного заключения [6].
Накануне этого визита Жан-Пьер Оран и Мари-Аньес Амос провели встречу с российскими представителями иностранных компаний, производственные площадки которых расположены, в частности, во Франции.

В марте вступили в силу изменения в Федеральный закон от 04.05.2011 г. № 99-ФЗ «О лицензировании отдельных видов деятельности», которыми предусмотрена новая процедура лицензионного контроля для отечественных производителей лекарственных средств «Периодическое подтверждение соответствия лицензионным требованиям» [7]. По результатам периодического подтверждения соответствия возможно получение заключения о соответствии требованиям Правил GMP.
В следующем месяце, Постановлением Правительства РФ от 12.04.2022 г. № 353 «Об особенностях разрешительной деятельности в Российской Федерации в 2022 году» было определено, для каких лицензиатов на 12 месяцев продлевается срок для периодического (первичного) подтверждения соответствия лицензионным требованиям. Это решение касается лицензиатов, у которых в 2022 году истекает трехлетний период, после которого необходимо пройти соответствующую процедуру [8, 9].
В апреле на сайте ФГБУ «ВГНКИ» были размещены «Методические рекомендации по подготовке к дистанционной инспекции иностранного производителя лекарственных средств для ветеринарного применения». В соответствии с этими рекомендациями:
- Заявитель и ответственные должностные лица инспектируемой производственной площадки обеспечивают дистанционное взаимодействие с использованием технических средств и согласовывают их с руководителем комиссии инспекторов. При этом необходимо учесть следующее:
- использование коммуникационных платформ для своевременного предоставления данных, особенно для файлов, обладающих большим размером;
- использование видеоконференции для обсуждения в реальном времени с персоналом производственной площадки;
- возможность предоставления видеозаписей с камеры в реальном времени или видеозаписей для удаленного анализа производственных операций, оборудования, помещений и соответствующей документации с указанием времени видеозаписи;
- разницу во времени между Москвой и страной, на территории которой находится инспектируемая производственная площадка;
- организацию работы переводчиков (с официального языка страны местонахождения производственной площадки на русский язык — не менее двух человек) в течение всего времени проведения инспектирования.
- Заблаговременно, не позднее чем за 5 рабочих дней до начала инспектирования производственной площадки, заявитель/производитель обеспечивает наличие документов, материалов и информации в электронном виде на русском языке, а также на оригинальном языке производителя (согласно приведенного перечня) путем их размещения в облачном хранилище с правом доступа для ознакомления комиссией инспекторов.
- Должностные лица в период проведения инспектирования должны подтвердить геолокацию инспектируемой производственной площадки, а также быть готовыми ответить на вопросы инспекторов и представить документы по их запросу согласно плану проведения инспектирования производства лекарственных средств [10].
Дополнительные рекомендации по подготовке к дистанционному инспектированию производителей лекарственных средств на соответствие требованиям Правил GMP можно найти здесь: https://pharmprom.ru/podgotovka-k-distancionnomu-gmp-inspektirovaniyu/
В середине апреля состоялся юбилейный XXX Московский международный ветеринарный конгресс MVC 2022. В рамках этого конгресса прошла секция «Бизнес и власть. Ломаем стереотипы» [11]. Заместитель директора Департамента санитарных, фитосанитарных и ветеринарных мер ЕЭК Владимир Субботин рассказал в своей презентации о единых правилах регулирования обращения ветеринарных лекарственных средств в ЕАЭС. Он отметил, что документы, подтверждающие соответствие производства ветеринарных лекарственных средств требованиям Правил GMP государств-членов ЕАЭС и выданные уполномоченными органами в соответствии с законодательством государств-членов ЕАЭС до 1 января 2021 года, действительны до окончания срока их действия, но не позднее 31 декабря 2025 года, и взаимно признаются уполномоченными органами всех государств-членов.
Исполнительный директор Ассоциации ветеринарных фармацевтических производителей «АВФАРМ» Семен Жаворонков в своем выступлении на тему «Что угрожает 35% зарегистрированных в России препаратов — мнение производителей» дал анализ основных рисков нового и уже действующего законодательства. В частности, он привел следующие статистические данные: если говорить только про GMP-инспектирование четырех ведущих зарубежных производителей ветеринарных препаратов, то на сегодняшний день лишь 7% иностранных производителей владеют российскими GMP-сертификатами. Если анализировать отдельно зарубежных химико-фармацевтических производителей, только 9% из них обладают российскими GMP-сертификатами, из производителей иммунобиологических ветеринарных препаратов — 6% [12].
По состоянию на середину 2022 года иностранные производители имеют 29 действующих GMP-заключений, количество которых за последние полгода было примерно на одном и том же уровне.
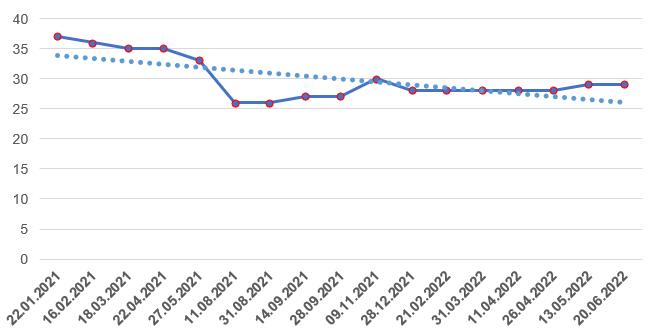
Российские производители на сегодняшний день имеют 15 действующих заключений.
В конце апреля, в рамках XI международного фармацевтического форума PharmPRO в Москве, была организована тематическая сессия «Управление качеством на производстве лекарственных препаратов». На этой сессии Ирина Краснова, заместитель директора департамента развития производства и регистрации OOO «НПФ «Материа Медика Холдинг», экс-директор по качеству, предостерегла участников форума от внесения неполной или излишней информации в регистрационное досье [13].
Еще в прошлом году, подводя итог четырехлетней деятельности GMP-инспектората на III Всероссийском Фармпробеге, Данил Рудняев расказал о том, что именно инспектирование позволило выявить проблему — большое количество несоответствий в отношении расхождения информации, содержащейся в регистрационном досье на лекарственный препарат и фактическим состоянием дел на производственной площадке; это простимулировало фармпроизводителей к проведению ревизии своих регистрационных досье. Сегодня большая часть производителей провели необходимую работу, актуализировали свои методы контроля и в целом стали больше уделять внимание к соблюдению стандартов качества [14].
Круглый стол, посвященный новым правилам регулирования обращения ветеринарных лекарственных средств на таможенной территории ЕАЭС, прошел в конце мая на площадке общероссийской общественной организации «Деловая Россия». Новые правила вступят в силу в 2024 году, однако у участников ветеринарного рынка накопился значительный объем вопросов и замечаний к тексту правил. Представители ЕЭК и Россельхознадзора во время круглого стола ответили на вопросы руководителей Ассоциации ветеринарных фармацевтических производителей «АВФАРМ» и Союза предприятий зообизнеса (СПЗ), а также присутствовавших производителей ветпрепаратов. В частности, обсуждались подходы к проведению GMP-инспекций, в том числе в дистанционном формате, возможности увеличения сроков предоставления CAPA-планов, а также признания GMP-сертификатов, выдаваемых национальными уполномоченными органами. По итогам круглого стола участники договорились подготовить общую резолюцию для последующей проработки отдельных решений, включая работу над внесением изменений в текст правил и создание документа с разъяснениями отдельных пунктов [15].
В июне в рамках деловой программы выставки «МVC: Зерно-Комбикорма-Ветеринария-2022» состоялась конференция «Состояние и перспективы решения вопросов импортозамещения в области обращения лекарственных средств для ветеринарного применения». На этой конференции заместитель директора ФГБУ «ВГНКИ» Василина Грицюк рассказала о том, как будут регистрировать ветеринарные препараты по упрощенной схеме [16].
В частности, согласно Приложению № 20 «Особенности разрешительных режимов в сфере обращения лекарственных препаратов для ветеринарного применения» Постановления Правительства РФ от 12.04.2022 № 353, до 1 сентября 2023 года для лекарственных препаратов для ветеринарного применения, произведенных на территории Российской Федерации в целях импортозамещения, устанавливается режим ускоренной процедуры государственной регистрации, не превышающий 60 рабочих дней, за счет отказа от экспертизы качества лекарственного препарата для ветеринарного применения при условии представления заключения о соответствии производственной площадки требованиям Правил GMP (за исключением живых вакцин и иммунобиологических препаратов против особо опасных заболеваний животных, указанных в перечне заразных, в том числе особо опасных, болезней животных, по которым могут устанавливаться ограничительные мероприятия (карантин), утверждаемом Министерством сельского хозяйства Российской Федерации) [9].
Предстоящие события и мероприятия
В мае открылась регистрация на VII Всероссийскую GMP-конференцию, которая состоится в Иркутске 7-8 сентября. Организатором конференции выступает Министерство промышленности и торговли Российской Федерации совместно с ФБУ «ГИЛС и НП». В последние годы на повестке конференции рассматриваются вопросы не только надлежащих производственных практик, но и надлежащих лабораторных, инженерных и других надлежащих практик (Good Practices, GxP). Кроме того, в рамках конференции проводятся круглые столы и тематические сессии по ветеринарному направлению. Во второй день работы состоится развернутый мастер-класс по надлежащим производственным практикам и проведению GMP-инспекций, посетить который возможно только в очном формате [17, 18].
21 октября в Москве пройдет IV Международная конференция «Логистика лекарственных средств». В частности, на конференции состоится церемония награждения Премией SCM Pharm 2022. Сообщество руководителей и специалистов по логистике и качеству SCM Pharm готовит издание Сборника практических статей GDP Review 3 [19].
9-10 ноября в Санкт-Петербурге состоится конференция ISPE ЕАЭС. Основная задача конференции — открытое обсуждение технических и технологических инноваций в области фармацевтического производства, последних регуляторных тенденций и практического опыта их реализации. Ежегодно к участию в деловой программе конференции приглашаются ведущие эксперты фармацевтической отрасли, представители органов власти и профильных ассоциаций, а также компании-производители из ЕАЭС и других стран [20].
Производителям ветеринарных препаратов рекомендуется принимать активное участие в событиях и мероприятиях, связанных с GM(D)P, и тщательнее готовиться к инспектированию.
Представленный материал подготовлен с использованием данных, актуальных на 30.06.2022. В случае получения новых или дополнительных данных статья может быть обновлена.
Константин Морозов, специалист по GMP, аудитор фармацевтических предприятий
ССЫЛКИ:
- Россельхознадзор / Деятельность / Госуслуги / Выдача заключения о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики / Дополнительная информация для заявителя / Государственный реестр заключений о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики. URL: https://fsvps.gov.ru/ru/gosuslugi/zaklyuchenie-o-sootvetstvii (дата обращения 30.06.2022)
- ФГБУ «ВГНКИ» / Структура / Отдел инспекции производства на соответствие требованиям надлежащей производственной практики / График проведения инспектирования иностранных производителей на соответствие требованиям надлежащей производственной практики. URL: https://www.vgnki.ru/assets/files/grafik-na-sajt-30062022(1).pdf (дата обращения 30.06.2022)
- Евразийский экономический союз / Решение Совета Евразийской экономической комиссии от 21.01.2022 № 1 «О Правилах регулирования обращения ветеринарных лекарственных средств на таможенной территории Евразийского экономического союза. URL: https://docs.eaeunion.org/Pages/DisplayDocument.aspx?s=%7Be1f13d1d-5914-465c-835f-2aa3762eddda%7D&w=9260b414-defe-45cc-88a3-eb5c73238076&l=%7B8a412e96-924f-4b3c-8321-0d5e767e5f91%7D&EntityID=32004 (дата обращения 30.06.2022)
- Евразийский экономический союз / Решение Совета Евразийской экономической комиссии от 14.07.2021 № 65 «О внесении изменений в Правила надлежащей производственной практики Евразийского экономического союза». URL: https://docs.eaeunion.org/docs/ru-ru/01429875/err_11082021_65 (дата обращения 30.06.2022)
- ФГБУ «ВГНКИ» / Главная / Пресс-центр / Новости / АНОНС: В ФГБУ «ВГНКИ» пройдет семинар, посвященный изменениям в подходах к квалификации и валидации на предприятии. URL: https://vgnki.ru/anons-v-fgbu-vgnki-projdet-seminar-posvyashhennyj-izmeneniyam-v-podhodah-k-kvalifikacii-i-validacii-na-predpriyatii.html (дата обращения 30.06.2022)
- ФГБУ «ВГНКИ» / Главная / Пресс-центр / Новости / ФГБУ «ВГНКИ» посетил директор французского Агентства по надзору за лекарственными средствами для ветеринарного применения (ANMV). URL: https://www.vgnki.ru/fgbu-vgnki-posetil-direktor-francuzskogo-agentstva-po-nadzoru-za-lekarstvennymi-sredstvami-dlya-veterinarnogo-primeneniya-anmv.html (дата обращения 30.06.2022)
- Электронный фонд правовых и нормативно-технических документов / Федеральный закон от 04.05.2011 г. № 99-ФЗ «О лицензировании отдельных видов деятельности» (редакция, действующая с 1 марта 2022 года). URL: https://docs.cntd.ru/document/902276657 (дата обращения 30.06.2022)
- Россельхознадзор / Новости / Россельхознадзор информирует производителей лекарственных средств для ветеринарного применения о продлении срока подтверждения соответствия лицензионным требованиям. URL: https://fsvps.gov.ru/ru/fsvps/news/209623.html (дата обращения 30.06.2022)
- Электронный фонд правовых и нормативно-технических документов / Постановление Правительства РФ от 12.04.2022 г. № 353 «Об особенностях разрешительной деятельности в Российской Федерации в 2022 году» (с изменениями на 15 июня 2022 года). URL: https://docs.cntd.ru/document/728461969 (дата обращения 30.06.2022)
- ФГБУ «ВГНКИ» / Структура / Отдел инспекции производства на соответствие требованиям надлежащей производственной практики / Полезная информация / Методические рекомендации по подготовке к дистанционной инспекции иностранного производителя лекарственных средств для ветеринарного применения. URL: https://www.vgnki.ru/otdel-inspekcii-proizvodstva-na-sootvetstvie-trebovaniyam-nadlezhashhej-proizvodstvennoj-praktiki.html (дата обращения 30.06.2022)
- XXX Московский международный ветеринарный конгресс / Мероприятия / Программа секций / XXX Ветконгресс / Второй день / Бизнес и власть. URL: https://vetcongress.ru/vetcongress30/day2/bus (дата обращения 30.06.2022)
- Зоомедвет / Новости / Что угрожает рынку ветеринарных препаратов в России? URL: https://zoomedvet.ru/?p=7140 (дата обращения 30.06.2022)
- PharmPRO / Блог / Управление качеством фармпрепаратов: итоги тематической сессии PharmPRO. URL: https://pharmpro.pro/blog/kachestvo/upravlenie-kachestvom-farmpreparatov/ (дата обращения обращения 30.06.2022)
- Фармпробег / Новости / Фармпробег-2021 в Суздале поднял тему фармацевтической системы качества. URL: https://pharmprobeg.ru/novosti/farmprobeg-2021-v-suzdale-podnyal-temu-farmatsevticheskoj-sistemy-kachestva/ (дата обращения обращения 30.06.2022)
- Ветеринария и жизнь / Главная / События / Эксперты обсудили новые правила работы единого рынка ветпрепаратов ЕАЭС. URL: https://vetandlife.ru/sobytiya/eksperty-obsudili-novye-pravila-raboty-edinogo-rynka-vetpreparatov-eaes/ (дата обращения 30.06.2022)
- Ветеринария и жизнь / Главная / Зообизнес / Эксперт: как будут регистрировать ветпрепараты по упрощенной схеме. URL: https://vetandlife.ru/sobytiya/ekspert-kak-budut-registrirovat-vetpreparaty-po-uproshhennoj-sheme/ (дата обращения 30.06.2022)
- ФБУ «ГИЛС и НП» / Новости / 2022 / Открыта регистрация на VII Всероссийскую GMP-конференцию. URL: https://gilsinp.ru/?news=otkryta-registratsiya-na-vii-vserossijskuyu-gmp-konferentsiyu (дата обращения 30.06.2022)
- VII Всероссийская GMP-конференция. URL: http://gosgmp.ru/ (дата обращения 30.06.2022)
- SCM Pharm / Проекты / Издания. URL: https://scmpharm.ru/projects/publishing/ (дата обращения 06.2022)
- Конференция ISPE ЕАЭС — 2022. URL: https://conference.ispe.ru/ (дата обращения 30.06.2022)


