В обзоре представлена информация, связанная с инспектированием производителей лекарственных средств для ветеринарного применения на соответствие требованиям Правил надлежащей производственной практики (Good Manufacturing Practice, GMP). Эти инспекции проводят специалисты подведомственного Россельхознадзору Федерального государственного бюджетного учреждения «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГБУ «ВГНКИ»).

Результаты инспектирования
С начала 2021 года инспектирование производителей лекарственных средств для ветеринарного применения осуществляется на соответствие требованиям Правил GMP Евразийского экономического союза (Правил GMP ЕАЭС), утвержденных Решением Совета ЕЭК от 03.11.2016 № 77 [1].
За прошедший год специалисты отдела инспекции производства на соответствие требованиям надлежащей производственной практики провели 32 инспекции иностранных производителей, в том числе 17 выездных и 15 в дистанционном формате. Кроме того, специалисты отдела в качестве экспертов приняли участие в 83 проверках российских производителей, проводимых Россельхознадзором, из них в 23 плановых проверках и 55 внеплановых [2].
Согласно реестру выданных заключений, опубликованному на сайте Россельхознадзора 28.12.2021 г., в 2021 году иностранным производителям было выдано 11 заключений о соответствии требованиям Правил GMP. Российским производителям было выдано 8 GMP-заключений [3].
По состоянию на конец 2021 года иностранные производители имели 28 действующих GMP-заключений; российские производители имели 12 действующих заключений.
Количество действующих GMP-заключений в 2021 году (иностранные производители)
При этом результаты некоторых инспекций, проведенных в 2021 году, могут стать известны только в 2022 году.
Комментируя результаты инспектирования иностранных производителей, Данил Рудняев, заместитель директора, руководитель Органа инспекции ФГБУ «ВГНКИ» рассказал во время интервью федеральному отраслевому изданию «Ветеринария и жизнь», что в 2021 году из 20 предприятий, которые проверили инспекторы, 13 были признаны несоответствующими требованиям GMP [4].
На сегодняшний день анализ результатов инспектирования иностранных производителей показывает следующие тренды:
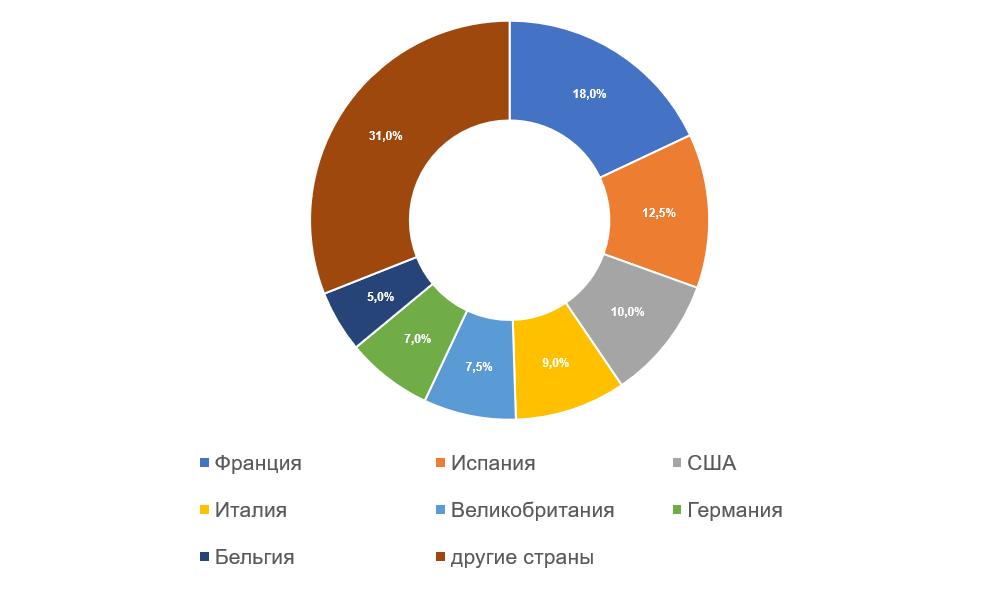
- производственные площадки, расположенные в Испании, по-прежнему демонстрируют лучшие результаты — за 2017-2021 годы они получили 9 GMP-заключений;
- производственные площадки, расположенные в США, Италии и Германии, показывают худшие результаты — за 2017-2021 годы они суммарно получили 28 отказов в выдаче заключений;
- количество отказов в выдаче заключений площадкам, расположенным во Франции, все еще остается высоким, однако за 2017-2021 годы они получили уже 7 GMP-заключений.
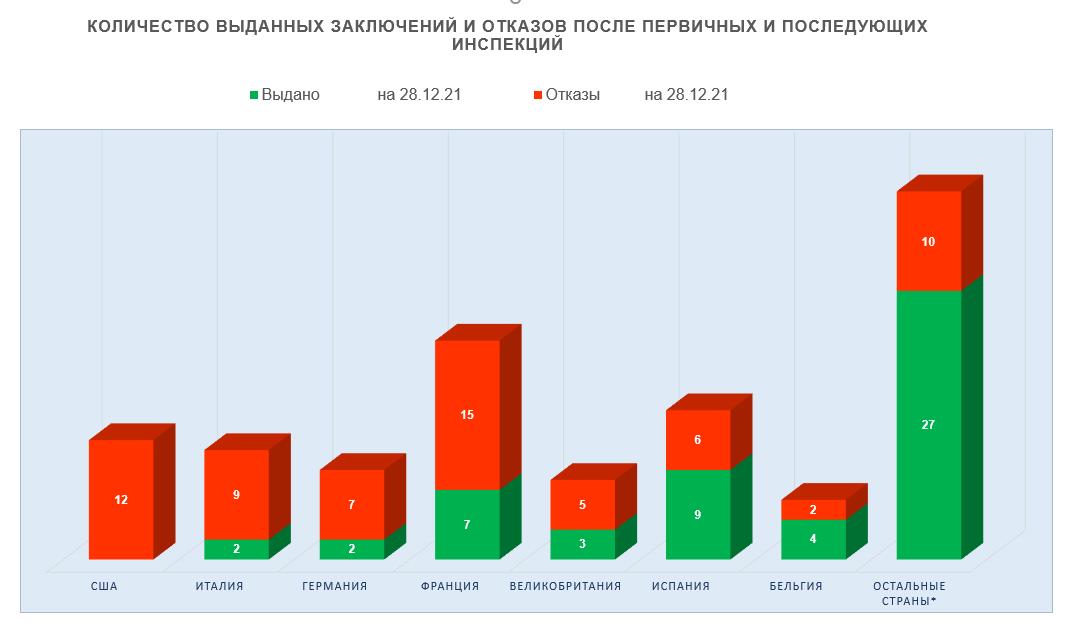
Наибольшее число инспекций (22), по результатам которых в 2017-2021 годах были приняты решения о выдаче (отказе в выдаче) GMP-заключения, было проведено на производственных площадках, расположенных во Франции. Российский рынок является значимым для французских производителей ветеринарных препаратов.
В 2021 году французские производители прошли только 2 инспекции — в связи со сложившейся неблагоприятной обстановкой, связанной с распространением новой коронавирусной инфекции, в настоящее время сохраняются некоторые ограничения на въезд во Францию.
Следует отметить, что в панельной дискуссии на последней Всероссийской GMP-конференции приняла участие Мари-Аньес Амос (Marie-Agnès Amos), заместитель советника по сельскому хозяйству, референт по ветеринарным, санитарным и фитосанитарным вопросам по России, Казахстану, Беларуси, Армении, Узбекистану, Таджикистану и Кыргызстану Экономической службы Посольства Франции в России [5].
Инспектирование в 2022 году
В соответствии с графиком проведения инспектирования, опубликованном на сайте ФГБУ «ВГНКИ» 28.12.2021 г., на 2022 год запланированы уже 44 инспекции производителей ветеринарных препаратов, площадки которых расположены в Австралии, Бельгии, Болгарии, Бразилии, Великобритании, Вьетнаме, Германии, Испании, Италии, Китае, Нидерландах, Словакии, США, Финляндии, Франции, Хорватии и Чехии [6].
Некоторые из этих инспекций были изначально запланированы на 2020-2021 годы, но затем они были перенесены на новые даты. Больше всего инспекций должно пройти во Франции, Испании, США и Китае.
События и мероприятия
Во второй половине прошлого года в России было проведено много различных мероприятий, которые могли бы быть полезными производителям для подготовки к инспектированию. В 2022 году также ожидается много интересных событий и мероприятий.
В 2021 году перечень учебных программ на базе Научно-методического базового центра ФГБУ «ВГНКИ» был расширен до 80, в том числе 7 новых программ для производителей лекарственных средств для животных [7].
В частности, в июле 2021 года в онлайн-формате состоялся семинар «Переход на Правила надлежащей производственной практики Евразийского экономического союза», на котором участники обучения рассмотрели и проанализировали изменения в области требований к фармацевтическому производству, персоналу, помещениям, оборудованию и документации [8]. На 2022 год подготовлено более 100 обучающих мероприятий, в том числе программ в форме индивидуального обучения. С годовым графиком занятий можно ознакомиться на сайте ФГБУ «ВГНКИ» [9].
В сентябре 2021 года в Торгово-промышленной палате Российской Федерации состоялся XVII форум субъектов предпринимательства в сфере зообизнеса. Полина Смышляева, заместитель директора Департамента ветеринарии Минсельхоза России, представила на форуме полный обзор нового законодательства в сфере ветеринарии, обращения ветеринарных препаратов, регистрации кормовых добавок и остановилась на актах, которые сейчас находятся в разработке [10].
«В следующем году нам предстоит урегулировать вопросы надлежащей дистрибьюторской практики (Good Distribution Practice, GDP). Я думаю, что в начале следующего года мы начнем разработку этого документа», — отметила Полина Смышляева [11].
В сентябре 2021 года в Санкт-Петербурге прошла VI Всероссийская GMP-конференция с международным участием, организованная Минпромторгом России совместно с ФБУ «ГИЛС и НП» [12].
В рамках конференции состоялись панельная дискуссия «Инспектирование производителей лекарственных препаратов для ветеринарного применения. Регулирование и статистика. Взгляд государства и бизнеса» и круглый стол «Актуальные вопросы инспектирования производителей лекарственных препаратов для ветеринарного применения на соответствие требованиям Правил надлежащей производственной практики», организатором которых выступили ФГБУ «ВГНКИ» и Ассоциация ветеринарных фармацевтических производителей «АВФАРМ» [13].
Более подробная информация о мероприятиях для производителей ветеринарных препаратов, которые прошли в рамках GMP-конференции, представлена в первом номере отраслевого журнала «ФАРМПРОМ» в формате онлайн.
В сентябре 2021 года состоялась онлайн-конференция «Заочная школа аудитора GMP/GDP». Этот ежегодный проект Группы компаний «ВИАЛЕК» — важное событие для внутренних аудиторов системы качества фармацевтических предприятий, руководителей и сотрудников отдела обеспечения качества, специалистов в области надлежащих фармацевтических практик (Good Practice, GxP).
Календарь предстоящих мероприятий представлен на сайте Группы компаний «ВИАЛЕК» [14]. Одиннадцатая фармацевтическая неделя качества «Обеспечение качества лекарственных средств» должна состояться в июне 2022 года в Армении [15].
В сентябре 2021 года сообщество руководителей и специалистов по логистике и качеству SCM Pharm выпустило Сборник практических статей GDP Review 2. Среди представленных в сборнике материалов можно отметить статью «GDP как инструмент повышения качества операционной деятельности» (Семен Жирнов, директор по логистике ГК ВИК и Мария Масленникова, менеджер по качеству ГК ВИК) и статью «Валидация системы температурного мониторинга при перевозке лекарственных средств в соответствии с требованиями GxP. Обеспечение целостности данных» (Александр Белинский, GxP-эксперт, в настоящее время — руководитель группы валидации компании «Апиценна») [16].
Сборник был подарен участникам III Международной конференции «Логистика лекарственных средств», прошедшей в Москве в октябре 2021 года [17].
В октябре 2021 года в рамках XXIII Всероссийской агропромышленной выставки «Золотая осень 2021» ФГБУ «ВГНКИ» совместно с Россельхознадзором провели конференцию «Контроль качества пищевой продукции — залог здорового общества» [18].
Данил Рудняев рассказал в своем выступлении о том, как проходят проверки площадок по производству лекарственных средств для ветеринарного применения на соответствие требованиям Правил GMP в период ограничений, связанных с пандемией новой коронавирусной инфекции. В 2020 году в онлайн-формате по заявкам было проинспектировано 10 из 16 зарубежных производств, а за 9 месяцев 2021 года — 10 из 18. Всего за два года в Россельхознадзор поступило 44 заявки от иностранных компаний на проведение дистанционных инспекций, 20 их них уже проведено, а 5 состоятся до конца года [19].
В ноябре 2021 года при поддержке Минпромторга России в Москве прошла Ежегодная конференция ISPE ЕАЭС [20].
«Регуляторный стол» начался с обзора GM(D)P нормативных актов в ЕАЭС. Руководитель отдела по инспектированию надлежащих фармацевтических практик НЦЭЛМТ Минздрава Армении Мкртыч Шакарян в своем выступлении сделал упор на процесс и программы подготовки фармацевтических инспекторов. В частности, он отметил, что сотрудничество регуляторов и профессиональных организаций, таких как ISPE, взаимоэффективно. Так, руководства ISPE применяют фармкомпании и фармацевтические инспектораты, ряд стандартов используется для стран ЕАЭС (приняты стандарты по применению очищенной воды). Полезной для фарминспекторов является образовательная платформа ISPE. «Мы, как представители инспектората, заинтересованы в повышении квалификации наших сотрудников по таким направлениям, как валидация технологических процессов, аналитических методик, очистки и компьютеризированных систем», — заявил Мкртыч Шакарян [21].
На сессии «Гармонизация требований к производству лекарственных средств» советник генерального директора по обеспечению качества «СКОПИНФАРМ» Евгения Олейникова сделала доклад о практической реализации требований GDP в контексте Правил GMP. Правила GMP ЕАЭС содержат в себе некоторые пункты, которые распространяют свое действие как на процессы дистрибьюции лекарственных средств, так в некоторых случаях и на сами компании-дистрибьюторы. Например, в Главе 1 («Фармацевтическая система качества») Правил GMP ЕАЭС указано, что «при оптовой реализации продукции необходимо свести к минимуму риски для ее качества и учитывать правила надлежащей дистрибьюторской практики», а в Главе 5 («Производство») сказано, что «для утверждения и поддержания статуса поставщиков активных фармацевтических субстанций и вспомогательных веществ требуется проведение аудитов производителей и дистрибьюторов фармацевтических субстанций. Держатель лицензии на производство лекарственного препарата обязан проверять соблюдение таких требований самостоятельно либо через лицо, действующее от его имени по контракту», — подчеркнула представитель «СКОПИНФАРМ» [22].
Член рабочей группы EMA, экс-президент локального отделения ISPE Франции Жан Франсуа Дюльер (Jean-François Duliere) в своем докладе рассказал о планируемых изменениях в Приложении 1 EU GMP. Как напомнил спикер, это приложение было впервые принято в 1989 году и неоднократно подвергалось доработке, но первое предложение о полном его пересмотре произошло только в 2012 году. К ноябрю прошлого года EMA получило 2 000 замечаний по двенадцатой версии проекта пересмотренного документа. В проект новой версии приложения было внесено множество изменений [23].
В четвертом квартале 2021 года Евразийская академия надлежащих практик провела серию бесплатных экспертно-консультационных вебинаров для производителей субстанций. Модератором прошедших вебинаров была Виктория Гортинская, заместитель генерального директора по образовательной деятельности компании «ФАРМСТРАТЕГИЯ» [24].
В ноябре в рамках выставки оборудования, сырья и технологий для фармацевтического производства PharmTech&Ingredients 2021, Академия представила симуляционный виртуальный фармацевтический комплекс «Виртуальный завод 2.0», который ранее уже был представлен в рамках GMP-конференции. Сценарий действий персонажей внутри виртуальной симуляции состоит из нескольких частей, каждая из которых максимально реалистично отражает процесс прохождения фармацевтической инспекции производства лекарственных средств на соответствие требованиям GMP [25].
На сайте Академии опубликован план образовательных мероприятий на 2022 год. В частности, на февраль 2022 года запланирован курс повышения квалификации «Подготовка аудиторов производства лекарственных препаратов» [26].
Планируемые изменения в рамках ЕАЭС
Сейчас в Российской Федерации в отношении лекарственных средств для ветеринарного применения действуют Правила организации и проведения инспектирования производителей лекарственных средств на соответствие требованиям правил надлежащей производственной практики, а также выдачи заключений о соответствии производителя лекарственных средств указанным требованиям, утвержденные Постановлением Правительства Российской Федерации от 03.12.2015 № 1314 «Об определении соответствия производителей лекарственных средств требованиям правил надлежащей производственной практики» [27].
В октябре 2021 года на правовом портале ЕЭК было опубликовано Распоряжение Коллегии ЕЭК № 170 «О проекте Решения Совета Евразийской экономической комиссии «О Правилах регулирования обращения ветеринарных лекарственных средств на таможенной территории Евразийского экономического союза» [28].
Приложение №26 к одобренному проекту Решения — Правила проведения фармацевтических инспекций. Эти Правила будут устанавливать единый порядок проведения фармацевтических инспекций производства ветеринарных лекарственных средств на соответствие требованиям Правил GMP ЕАЭС. В частности, в Правилах предусмотрено следующее:
- Инспекция проводится фармацевтическими инспекторами уполномоченного в сфере обращения ветеринарных лекарственных средств органа (уполномоченной организации) или ветеринарным фармацевтическим инспекторатом государства-члена ЕАЭС
- В случае если при проведении инспекции были выявлены несоответствия, инспектируемый субъект в сфере обращения ветеринарных лекарственных средств не позднее 30 календарных дней со дня получения отчета , направляет в уполномоченный орган, организовавший инспекцию, ответ с приложением плана корректирующих и предупреждающих действий (CAPA-плана), и отчета о его выполнении с материалами, подтверждающими факт их выполнения, с которыми должны быть ознакомлены ведущий фармацевтический инспектор и все члены инспекционной группы, проводившей инспекцию
- В течение 30 календарных дней со дня получения ответа с САРА-планом и отчетом о его выполнении уполномоченный орган (уполномоченная организация) или ветеринарный фармацевтический инспекторат осуществляет оценку содержащейся в нем информации и выполняет повторную (контрольную) инспекцию с целью подтверждения устранения выявленных в ходе ранее проведенной инспекции несоответствий
- Повторная (контрольная) инспекция по решению уполномоченного органа (уполномоченной организации) или ветеринарного фармацевтического инспектората, ответственного за проведение первоначальной инспекции, может проводиться методом документарного инспектирования представленных инспектируемым субъектом документов (без выезда на объект) или выездного инспектирования объекта с целью устранения несоответствий, выявленных на нем в ходе первоначальной инспекции (с выездом на объект)
- Уполномоченный орган в срок, не превышающий 35 календарных дней со дня подписания инспекционного отчета, принимает решение о выдаче (отказе в выдаче) сертификата
- Сертификат выдается уполномоченным органом в срок не позднее 10 календарных дней от даты принятия им решения о выдаче сертификата при условии устранения субъектом в сфере обращения ветеринарных лекарственных средств всех критических и существенных несоответствий, а также прочих несоответствий, если в совокупности они представляют собой существенные несоответствия
- В случае выявления при проведении инспекции критических несоответствий требованиям Правил GMP уполномоченный орган может принять решение о приостановлении или прекращении действия ранее выданного сертификата, о чем в течение 5 рабочих дней со дня завершения инспекции письменно уведомляет проинспектированного субъекта, а также уполномоченные органы других государств-членов и ЕЭК.
Во время интервью изданию «Ветеринария и жизнь», на вопрос о том, что ожидает сферу ветеринарных препаратов в следующем году, Данил Рудняев ответил: «Мы очень давно ждем выхода документа о правилах регулирования обращения лекарственных средств для ветеринарного применения на рынке ЕАЭС. Данный проект обсуждается уже очень давно, начиная с 2015 года. Мы ждали, что он выйдет в 2019 году, но дискуссии по его содержанию между странами-членами ЕАЭС до сих пор продолжаются. Хотелось бы, чтобы этот документ наконец-то вышел, вступил в силу, и мы начали по нему работать; потому что общие правила, если они будут на рынке всего Евразийского экономического союза, будут «общими правилами игры» для всех стран-членов. Мы будем понимать, что процессы, которые проходят в Российской Федерации, полностью эквивалентны процессам, проходящим в государствах Союза, и мы им полностью можем доверять» [4].
Производителям ветеринарных препаратов рекомендуется принимать активное участие в событиях и мероприятиях, связанных с GM(D)P, и тщательнее готовиться к инспектированию.
Представленный материал подготовлен с использованием данных,
актуальных на 31.12.2021.
В случае получения новых или дополнительных данных
статья может быть обновлена.
Ссылки:
- Евразийский экономический союз / Решение Совета Евразийской экономической комиссии от 03.11.2016 г. № 77 «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза». URL: https://docs.eaeunion.org/docs/ru-ru/01411921/cncd_21112016_77 (дата обращения 12.2021)
- ФГБУ «ВГНКИ» / Главная / Пресс-центр / Новости / Результаты работы подведомственного Россельхознадзору ФГБУ «ВГНКИ» за 2021 год. URL: http://www.vgnki.ru/rezultaty-raboty-podvedomstvennogo-rosselhoznadzoru-fgbu-vgnki-za-2021-god.html (дата обращения 31.12.2021)
- Россельхознадзор / Регистрация и лицензирование / Инспектирование. Выдача заключения / Реестр заключений о соответствии производителя требованиям правил надлежащей производственной практики. URL: https://fsvps.ru/fsvps/regLicensing/conclusion/conclusionReestr.html (дата обращения 31.12.2021)
- Ветеринария и жизнь / Главная / Зообизнес / Эксперт рассказал, как проходят GMP-инспекции производителей ветпрепаратов. URL: https://vetandlife.ru/sobytiya/ekspert-rasskazal-kak-prohodyat-gmp-inspekcii-proizvoditelej-vetpreparatov/12.2021)
- Союз предприятий зообизнеса / Новости / Инспектирование производителей ветеринарных препаратов обсудили на Всероссийской GMP-конференции. URL: http://www.spzoo.ru/cntnt/default/n7045.html (дата обращения 31.12.2021)
- ФГБУ «ВГНКИ» / Структура / Отдел инспекции производства на соответствие требованиям надлежащей производственной практики / График проведения инспектирования иностранных производителей на соответствие требованиям надлежащей производственной практики. URL: http://www.vgnki.ru/assets/files/grafik-na-sajt-28122021.pdf (дата обращения 31.12.2021)
- ФГБУ «ВГНКИ» / Главная / Пресс-центр / Новости / Итоги деятельности Научно-методического базового центра ФГБУ «ВГНКИ» за 2021 год. URL: http://www.vgnki.ru/itogi-deyatelnosti-nauchno-metodicheskogo-bazovogo-centra-vserossijskogo-gosudarstvennogo-centra-kachestva-i-standartizacii-lekarstvennyh-sredstv-dlya-zhivotnyh-i-kormov-fgbu-vgnki.html (дата обращения 31.12.2021)
- ФГБУ «ВГНКИ» / Главная / Пресс-центр / Новости / В ФГБУ «ВГНКИ» прошел онлайн-семинар «Переход на правила надлежащей производственной практики Евразийского экономического союза». URL: http://www.vgnki.ru/v-fgbu-vgnki-proshel-onlajn-seminar-perehod-na-pravila-nadlezhashhej-proizvodstvennoj-praktiki-evrazijskogo-ekonomicheskogo-soyuza.html (дата обращения 31.12.2021)
- ФГБУ «ВГНКИ» / Главная / Пресс-центр / Новости / План обучающих мероприятий ФГБУ «ВГНКИ» на 2022 год. URL: http://www.vgnki.ru/plan-obuchayushhih-meropriyatij-fgbu-vgnki-na-2022-god.html (дата обращения 31.12.2021)
- Союз предприятий зообизнеса / Главная / В Москве состоялся XVII Форум субъектов предпринимательства в сфере зообизнеса. URL: http://www.spzoo.ru/cntnt/default/n7061.html (дата обращения 31.12.2021)
- Ветеринария и жизнь / Главная / События / Для продавцов ветпрепаратов разработают правила надлежащей дистрибьюторской практики. URL: https://vetandlife.ru/sobytiya/dlya-prodavtsov-vetpreparatov-razrabotayut-pravila-nadlezhashchey-distribyutorskoy-praktiki/ (дата обращения 31.12.2021)
- VI Всероссийская GMP-конференция с международным участием / Программа. URL: https://gosgmp.ru/vi-vserossijskaya-gmp-konferentsiya-programma-vi-vserossijskoj-konferentsii-2021/ (дата обращения 31.12.2021)
- ФГБУ «ВГНКИ» / Главная / Пресс-центр / Новости / Эксперты ФГБУ «ВГНКИ» приняли участие в VI Всероссийской GMP-конференции. URL: http://www.vgnki.ru/eksperty-fgbu-vgnki-prinyali-uchastie-v-vi-vserossijskoj-gmp-konferencii.html (дата обращения 31.12.2021)
- Виалек / Главная / Мероприятия. URL: https://www.vialek.ru/events/ (дата обращения 31.12.2021)
- Одиннадцатая фармацевтическая неделя качества «Обеспечение качества лекарственных средств». URL: https://www.pharm-quality.org/ (дата обращения 31.12.2021)
- ФармПром.РФ / Анонсы / SCM Pharm выпустило второй по счету «Сборник практических статей GDP Review». URL: https://inpharmation.ru/scm-pharm-vypustilo-vtoroj-po-schetu-sbornik-prakticheskix-statej-gdp-review/ (дата обращения 31.12.2021)
- Фармсовет.РФ / III Международная конференция: Логистика лекарственных средств / Конференция / Программа конференции. URL: https://xn--80aej0akkilk.xn--p1ai/#rec331272190 (дата обращения 31.12.2021)
- XXIII Всероссийская агропромышленная выставка «Золотая осень 2021» / Деловая программа / 05 октября / Конференция «Контроль качества пищевой продукции — залог здорового общества». URL: https://russianagroweek.ru/program/ (дата обращения 31.12.2021)
- ФГБУ «ВГНКИ» / Главная / Пресс-центр / Новости / В рамках «Золотой осени» эксперты ФГБУ «ВГНКИ» провели конференцию, посвящённую контролю безопасности пищевой продукции. URL: http://www.vgnki.ru/v-ramkah-zolotoj-oseni-eksperty-fgbu-vgnki-proveli-konferenciyu-posvyashhyonnuyu-kontrolyu-bezopasnosti-pishhevoj-produkcii.html (дата обращения 31.12.2021)
- ISPE ЕАЭС / Мероприятия / Конференция ISPE ЕАЭС — 2021 / Программа. URL: https://conference.ispe.ru/uploads/2021/11/ISPE_rus_1511.pdf (дата обращения 31.12.2021)
- ISPE ЕАЭС / Новости / Что нового в фармрегуляторике ЕАЭС и в части повышения квалификации инспекторов? URL: https://ispe.ru/news/chto-novogo-v-farmregulyatorike-eaes-i-v-chasti-povysheniya-kvalifikacii-inspektorov/ (дата обращения 31.12.2021)
- ISPE ЕАЭС / Новости / На чем сфокусироваться при соблюдении GDP в контексте правил GMP? URL: https://ispe.ru/news/na-chem-sfokusirovatsya-pri-sobljudenii-gdp-v-kontekste-pravil-gmp/ (дата обращения 31.12.2021)
- ISPE ЕАЭС / Новости / Что нового в части GMP ЕС? URL: https://ispe.ru/news/chto-novogo-v-chasti-gmp-es/ (дата обращения 31.12.2021)
- Евразийская Академия надлежащих практик / Об Академии / Новости и события / Евразийская академия надлежащих практик открывает серию бесплатных экспертно-консультационных вебинаров для производителей субстанций. URL: https://gxp-academy.org/about/news_and_events/428/ (дата обращения 31.12.2021)
- Евразийская Академия надлежащих практик / Об Академии / Новости и события / Евразийская Академия надлежащих практик – участник PharmTech 2021! URL: https://gxp-academy.org/about/news_and_events/442/ (дата обращения 31.12.2021)
- Евразийская Академия надлежащих практик / Образовательная деятельность / Курсы / «Подготовка аудиторов производства лекарственных средств». URL: https://gxp-academy.org/education/courses/kurs-pk-podgotovka-auditorov-proizvodstva-lekarstvennykh-sredstv-/ (дата обращения 31.12.2021)
- ФГБУ «ВГНКИ» / Структура / Отдел инспекции производства на соответствие требованиям надлежащей производственной практики / Нормативно-правовая документация. URL: http://www.vgnki.ru/assets/files/post-1314.pdf (дата обращения 31.12.2021)
- Евразийский экономический союз / Распоряжение Коллегии ЕЭК № 170 «О проекте решения Совета Евразийской экономической комиссии «О Правилах регулирования обращения ветеринарных лекарственных средств на таможенной территории Евразийского экономического союза». URL: https://docs.eaeunion.org/docs/ru-ru/01430349/err_22102021_170 (дата обращения 31.12.2021

