Аутсорсинг или работы «по контракту» широко используются в различных сферах деятельности, среди которых и фармацевтика. Имплементация аутсорсинга в фармацевтической отрасли, в силу специфики, имеет свои отличительные черты. Существуют национальные требования надлежащей производственной практики (Good Manufacturing Practice – GMP), в которых частично представлены требования к производству и анализу по контракту, но они ограничены только определением ответственности производителя перед регуляторными органами Украины при регистрации лекарственных средств (ЛС) и выдаче лицензии на производство. По нашему убеждению, аутсорсинг, в частности контрактное производство и анализ, имеет большие перспективы как бизнес-модель, но в Украине пока не пользуется такой популярностью как в странах Западной Европы и Азии из-за недостаточной информированности общественности о механизмах реализации и потенциальных возможностях. В данной статье авторами изложено собственное видение аутсорсинга с акцентом на производство и анализ по контракту
Термин «аутсорсинг» пришел к нам из английского языка и в дословном переводе означает «внешний источник». Истоки аутсорсинга уходят корнями в 30-е гг. ХХ века – время противостояния менеджеров Генри Форда и Алена Слоуна, а термин появился в 90-е. Аутсорсингом называется передача организацией определенных бизнес-процессов или функций на обслуживание другой компании, которая специализируется в соответствующей области [1, 2].
Фармацевтический бизнес пережил множество метаморфоз и сегодня уже не представляет собой натуральное хозяйство. Из анализа своей деятельности Генри Форд вынес урок, что ни одна фирма не может быть самодостаточной. Фармацевтические компании, полагающиеся на собственные возможности, в большей или меньшей степени искусственно ограничивают себя в развитии, полагая, что они не имеют достаточных бизнес возможностей, чтобы определить, разработать, легализовать, произвести, проанализировать и продать продукцию, которая, по их мнению, могла бы иметь успех на рынке и принести прибыль владельцу. Для успешного функционирования в условиях глобализации, экономической нестабильности, быстро изменяющегося рынка, от компаний требуется высокая скорость реагирования и эффективность. В этом отношении использование аутсорсинга представляется неким «мануфактурным разделением труда». В целях повышения конкурентоспособности (табл. 1) применяется подход деления функций на ключевые и второстепенные, а затем второстепенные функции передаются специалисту в данной сфере. К аутсорсингу часто прибегают высокотехнологичные компании, которым часто не хватает времени и ресурсов для выстраивания полной цепочки, необходимой для выпуска и коммерциализации.
Для эффективного использования данной модели на первом этапе, фармацевтической организации необходимо определиться с тем, какие функции или бизнес-процессы являются для нее ключевыми – ее сильными сторонами. После этого станет возможным вычленение бизнес-процессов и/или функций, которые можно/нужно передать на аутсорсинг. Выделенные ключевые бизнес-процессы могут приносить дополнительную прибыль, если компании будут предлагать свои услуги в качестве контрактной организации, что позволит также диверсифицировать и расширить существующие виды деятельности. При этом компании получают возможность задействовать свободные ресурсы, фокусироваться на ключевых компетенциях и совершенствовать их.
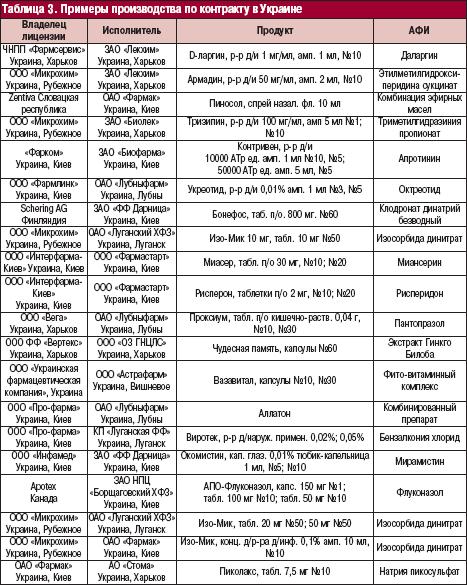
Доклинические и клинические исследования, разработка, оптимизация, масштабирование рецептур и технологий, валидация технологических процессов, регистрация, производство, анализ, реклама, продвижение и дистрибуция – вот далеко не полный и не подробный перечень процессов и услуг, которые подпадают под аутсорсинг в фармацевтических компаниях. Из вышеперечисленного производственный аутсорсинг играет одну из ведущих ролей в повышении конкурентоспособности промышленных организаций. Возможность производственного аутсорсинга предусмотрена сGMP и национальным законодательством [3]. Ряд национальных компаний может представлять интерес как потенциальный производитель по контракту (табл. 2, 3).
Сложный процесс принятия решения об аутсорсинге услуг можно упростить, разделив его на четыре последовательных шага [3, 4]:
- формирование внутриорганизационной философии о роли аутсорсинга. Определение стратегии и цели проекта;
- оценка и выбор контрактной организации (размещение, предоставляемые услуги);
- разработка контракта – «правил игры»;
- управление аутсорсингом после подписания контракта для достижения желаемой цели.
В качестве инструмента, облегчающего принятие решения об аутсорсинге, консультанты Driscoll Consulting Groupe предлагают использовать Gameplan (рис. 1) [5].

При оценке и выборе контрактного производителя организация-заказчик должна руководствоваться определенными принципами и учитывать ряд критериев. В национальном GMP указывается, что заказчик несет ответственность за оценку возможности исполнителя успешно выполнять необходимую роботу и за внесение в контракт положений, которые гарантируют соблюдение принципов и правил национального GMP [3]. Таким образом, выбор контрактной организации должен базироваться на системе обеспечения качества (в том числе, на системе анализа рисков) с участием контрактного производителя.
Как правило, уровень ответственности контрактного производителя зависит от степени близости контрактной стадии производственного процесса к готовой продукции. Таким образом, отданная контрактному производителю первая стадия процесса будет менее критична, чем последняя. Важным аспектом контрактного производства является возможность проведения валидации контрактного технологического процесса (стадии).

Для того, чтобы рассматривать организацию как потенциального исполнителя, контрактная организация должна иметь:
отчеты по квалификации основного производственного оборудования, систем обеспечения производства;
документированные процедуры о порядке проведения квалификации/реквалификации;
возможности для проведения квалификации:
— наличие в штате ответственных лиц (согласно должностным инструкциям);
— наличие подписанных соглашений с третьими лицами о проведении квалификации;
— понимание необходимости процесса квалификации.
Положительное заключение по вышеприведенным пунктам делает возможным проведение валидации технологического процесса, а значит, дает возможность рассматривать организацию как потенциального контрактного производителя.
Как правило, функцию планирования валидации заказчик оставляет за собой, а ответственность за достоверность предоставляемой информации лежит на исполнителе. Все документы (протоколы, формы и т.п.) должны быть переданы контрактному производителю, для проведения запланированных мероприятий. Формы, передаваемые контрактному производителю, должны содержать минимальный объем информации, необходимый только для сбора данных в определенных точках процесса и при определенных условиях. Между тем, формат оценки результатов валидации и интерпретация данных должна быть понятна, прозрачна и согласована с контрактным производителем. По результатам таких валидаций можно судить о степени доверия контрактному производителю и о возможностях взаимного сотрудничества в дальнейшем.
Важными аспектами при выборе исполнителя являются: доверие к организации, ее надежность, гибкость, опыт; наличие необходимых навыков, квалификации; уровень сервиса, система коммуникации и возможные коммуникативные барьеры (язык, культура); навыки управления и внутренние политики [5].
Принципы GMP в отношении производства и анализа ЛС собственными ресурсами и осуществления этой деятельности «по контракту» не отличаются. В случае контрактного производства и анализа ЛС между заказчиком и исполнителем происходит перераспределение обязанностей и ответственности, которые формализуются в контракте.
Технические аспекты контракта должны составлять компетентные лица, которые имеют соответствующие знания в области фармацевтических технологий, аналитической химии и надлежащей производственной практики [3].
Контракт, как правило, представляет собой систему взаимосвязанных соглашений. В зависимости от предмета контракта, соглашением верхнего уровня является Production Agreement (Соглашение о производстве) или Service Level Agreement (Соглашение об уровне сервиса), или Packaging Agreement (Соглашение по упаковке). Соглашение первого уровня ссылается на соглашения второго: Quality Agreement (Соглашение по качеству) и Supply
Agreement (Соглашение по поставкам). Quality Agreement и Supply Agreement сильно отличаются своей спецификой, поэтому чтобы избежать трудностей в разработке и согласовании, их выделяют в отдельные документы и связывают между собой перекрестными ссылками [5, 6].
Production Agreement включает предмет договоренности, условия выполнения и порядок расчетов.
В Quality Agreement, как неотъемлемой части системы взаимосвязанных соглашений, освещаются аспекты cGMP, QM (Quality Management – Управление качеством), QC (Quality Control – Контроль качества). Все договоренности относительно производства и анализа приводятся в соответствие регистрационному досье и согласовываются обеими сторонами. Согласно национальному GMP, в контракте должно быть зафиксировано [3]:
- каким образом Уполномоченное лицо, которое выдает разрешение на выпуск серии продукции для продажи, гарантирует, что каждая серия была произведена и проверена в соответствии с требованиями регистрационного досье и действующим законодательством Украины;
- кто несет ответственность за закупку материалов, проведение испытаний и выдачу разрешения на использование материалов, проведение технологического процесса и контроль качества, отбор проб и анализ;
- у кого должны храниться протоколы производства, анализа, дистрибуции и контрольные образцы;
- право заказчика инспектировать технические средства исполнителя;
- инспектирование исполнителя уполномоченным государственным органом.
Заказчик должен гарантировать, что вся произведенная и поставленная исполнителем продукция соответствует своим спецификациям, или то, что продукция была разрешена для выпуска Уполномоченным лицом заказчика и/или исполнителя. В этом контексте, ключевым аспектом Quality Agreement является формализация распределения ответственностей Уполномоченных лиц.
Все риски, связанные с качеством продукции на стадиях контрактного производства, должны быть проанализированы и изложены в соглашении по качеству до подписания контракта между производителем и заказчиком. Результаты контроля качества по взаимному соглашению двух уполномоченных лиц могут быть признаны без перепроверки.
На стадии формирования соглашения по качеству должны быть заложены предпосылки валидации технологического процесса. В самом соглашении необходимо подробно описать планирование и проведение валидации контрактного технологического процесса (стадии).
В Supply Agreement оговариваются аспекты, связанные со сроками и условиями поставок, планированием (например, планирование объемов производства контрактной организацией), конфиденциальностью, другими специфичными аспектами [5, 6].
Контрактом должны быть предусмотрены возможности управления бизнес-процессом, отданным на контрактное исполнение. Для выполнения контракта создается группа, состоящая из руководящего персонала организации-заказчика и организации-исполнителя. На протяжении всего срока действия контракта она должна регулярно обмениваться информацией. Также должен быть назначен руководитель контракта. В функции группы могут входить:
- отслеживание уровня обслуживания;
- анализ деятельности с целью предотвращения проблем;
- утверждение назначения или увольнения ведущих специалистов, участвующих в процессе обслуживания;
- утверждение необходимых изменений в мероприятиях, предусмотренных контрактом;
- ответственность за общую эффективность руководства контрактом.
В силу специфики фармацевтической отрасли особое внимание необходимо уделить качеству. На стадии разработки контракта должны быть разделены сферы ответственности заказчика и исполнителя. Как правило, структуру качества можно представить в виде трех подчиненных систем: Quality Мanagement (Система управления качеством) > Quality Assurance (Система обеспечения качества) > Quality Control (Система контроля качества). Quality Management, как всеобъемлющая система для качества, обычно остается в сфере влияния заказчика, Quality Assurance может быть отдана на полный или частичный аутсорсинг, а Quality Control, как правило, передается на полный аутсорсинг с предусмотренной возможностью проведения аудитов и доступа к первичным документам контроля.
Резюме
Бизнес-модель с использованием аутсорсинга открывает ряд возможностей как для заказчика услуг, так и для исполнителя. Однако, успешная реализация данной бизнес-модели возможна при использовании специфических подходов и соблюдении ряда требований, среди которых сGMP. Очень важным шагом является разработка контракта – «правил игры». Ответственность за качество и распределение этой ответственности является одним из ключевых аспектов контракта (Quality Agreement). Правильно организованные взаимоотношения между заказчиком и исполнителем, а так же управление контрактом, позволяют извлечь обоюдную выгоду из аутсорсинга.
Список ссылок:
[1] www.cio.com
[2] www.sourcingmag.com
[3] Настанова «Лікарські засоби. Належна виробнича практика»
[4] www.koreaccess.com
[5] www.contractpharma.com
[6] www.mastercontrol.com
Валентин Могилюк, Евгений Резцов, Дмитрий Рябко, Елена Могилюк
Журнал «Фармацевтическая отрасль», февраль №1 (18) 2010







