В фармацевтической отрасли закупка критической продукции, подрядных работ и услуг возможна только у предварительно одобренных поставщиков, т.е. прошедших (подтвердивших) квалификацию. Для этого должны быть определены критерии ВЫБОРА, ОЦЕНКИ и периодической ПЕРЕОЦЕНКИ поставщиков.
Поставщик – термин собирательный. К ним относятся производители и (или) дистрибьюторы сырья и материалов, подрядчики, исполнители услуг, посредники (брокеры) и т.п.

Недостаточно контролировать поступающее сырье и материалы (проводить т.н. входной контроль), необходимо иметь гарантии его соответствия еще на этапе принятия решения о целесообразности работы с поставщиком – проводить т.н. квалификацию поставщиков. По результатам квалификации может изменяться стратегия контроля качества – поставка сырья от одного поставщика может требовать усиленного входного контроля (контроль подлинности каждого контейнера, контроль каждой серии по всем показателям спецификации или даже большее количество показателей), а того же сырья от другого поставщика – только подтверждения прослеживаемости цепи поставок. При работе с надежными поставщиками – входной контроль избыточен.
Хорошо ПРОДУМАННАЯ, СБАЛАНСИРОВАННАЯ, РИСК-ОРИЕНТИРОВАННАЯ модель квалификации может обеспечить большую экономию ресурсов за счет отказа и (или) снижения уровня входного контроля. По некоторым позициям такая экономия может достигать до 1 млн. дол. США за год.
Ожидания уполномоченных органов
Основной принцип правил GMP/GDP – обеспечить производство и (или) обращение лекарственных препаратов на уровне позволяющем гарантировать их соответствие своему назначению, материалам регистрационного досье и лицензионным требованиям, так чтобы исключить риск ля здоровья пациентов, связанный с безопасностью, неудовлетворительным качеством и эффективностью. Выполнение данного принципа требует ответственности поставщиков и дистрибьюторов.
Базовые требования GMP к работе с поставщиками сырья и материалов заявлены в Части 1 GMP:
- Спецификации на сырье, первичные и печатные упаковочные материалы должны содержать ссылки на ОДОБРЕННЫХ поставщиков (пункт 4.14(а));
- В рамках фармацевтической системы качества (ФСК) должны быть разработаны МЕРЫ по ВЫБОРУ и ПЕРИОДИЧЕСКОЙ ОЦЕНКЕ поставщиков (пункт 1.4 (а));
- Выбор, ОЦЕНКА (КВАЛИФИКАЦИЯ), УТВЕРЖДЕНИЕ и работа с поставщиками сырья и материалов должно ДОКУМЕНТИРОВАТЬСЯ в ФСК (пункт 5.27). В наличии должны быть письменные ПОЛИТИКИ, ПРОЦЕДУРЫ, ПРОТОКОЛЫ, ОТЧЕТЫ и ЗАПИСИ, относящиеся к действиям в отношении поставщиков (пункт 4.29);
- Предпринимаемые усилия должны СООТВЕТСТВОВАТЬ РИСКАМ, связанным с использованием сырья и материалов (пункт 5.27).
Например, если поставщик отнесен к высокому уровню риска и, в то же время, у него низкий стратегический потенциал – с ним лучше минимизировать отношения, а если, наоборот, стратегический потенциал высокий – придется взять на поруки. Соответственно, уровень усилий при квалификации поставщика зависит от выбранной модели взаимодействия. Как минимум, в работе с ними нужна политика сегментации и выбора приоритетов.
- Для каждого УТВЕРЖДЕННОГО поставщика в наличии должны быть ПОДТВЕРЖДАЮЩИЕ СВИДЕТЕЛЬСТВА. Персоналу, вовлеченному в данную деятельность, необходимо иметь АКТУАЛЬНЫЕ ЗНАНИЯ о поставщиках, цепях поставок и связанных с ними рисках. ПО ВОЗМОЖНОСТИ сырье следует приобретать непосредственно у их ПРОИЗВОДИТЕЛЯ (пункт 5.27).
В соответствии с пунктом 5.29 Части 1 GMP для УТВЕРЖДЕНИЯ и ПОДДЕРЖАНИЯ СТАТУСА поставщиков АФС и вспомогательных веществ требуется следующее:
- Должна быть установлена ПРОСЛЕЖИВАЕМАЯ цепь поставки. Записи о ней должны быть в наличии и сохраняться;
- Связанные с цепью поставки РИСКИ (от исходных материалов для АФС до лекарственного препарата) должны ПОДВЕРГАТЬСЯ ФОРМАЛИЗОВАННОЙ ОЦЕНКЕ и ПЕРИОДИЧЕСКОЙ ПРОВЕРКЕ. Должны существовать соответствующие МЕРЫ ПО СНИЖЕНИЮ степени риска в отношении качества АФС;
- Для производителей и дистрибьюторов АФС требуется подтверждение соответствия требованиям GMP/GDP с помощью аудита;
- ВСПОМОГАТЕЛЬНЫЕ ВЕЩЕСТВА и их ПОСТАВЩИКИ должны контролироваться на основе результатов ФОРМАЛИЗОВАННОЙ ОЦЕНКИ РИСКОВ ДЛЯ КАЧЕСТВА.
По факту аналогичная ситуация с упаковочными материалами. В соответствии с пунктом 5.40 Части 1 GMP «закупке, хранению и контролю ПЕРВИЧНЫХ и ПЕЧАТНЫХ упаковочных материалов необходимо уделять такое же внимание, как и сырью».
В правилах GDP все намного проще, но они также устанавливают требования о квалификации поставщиков (пункт 5.2 GDP).
Аналогичная история в ISO 9001 «организация должна обеспечить, чтобы поставляемые ей извне процессы, продукция и услуги соответствовали требованиям. Организация должна установить (определить) средства и методы управления, которые должны быть к ним применены» (пункт 8.4.1)
и т.д.
Цели квалификации
Квалификация – это от англ. qualification, документированное подтверждение того, что поставщик соответствует целям производителя лекарственных препаратов и набору заданных им критериев.
Основные цели квалификации поставщиков:
- оценка рисков, сопряженных с поставщиком
- отсев ненадежных (проблемных, незаинтересованных, уличенных в нарушениях) поставщиков;
- отслеживание динамики развития и взаимных отношений;
- вовлечение (или воспитание) поставщиков.
По результатам квалификации
- определяется категория поставщика;
- устанавливается его рейтинг;
- возможно, инициируется его замена и (или) поиск альтернативного поставщика для диверсификации рисков;
- вносятся изменения и (или) дополнения в договоры и (или) соглашения о качестве (при необходимости), и т.п.
Категоризация поставщиков
По результатам квалификации поставщики могут делиться на несколько категорий. Система категоризации может быть простой, может быть сложной. Простая система, например, – это одобренный и отклоненный;более сложная – одобренный поставщик 1-й категории (надежный), одобренный 2-й категории, одобренный 3-й категории (временно одобренный), и соответственно, отклоненный 1-й категории (карантин до момента устранения выявленных недостатков), отклоненный 2-й категории (карантин на 6-24 мес.) и отклоненный 3-й категории (отнесенный в т.н. «черный список»). Можно проще, поставщики групп А, В, С (одобренные) и групп D, E, F (отклоненные) и т.п. Возможны разные варианты. Ваши поставщики – ваши модели их категоризации.
Для целей квалификации может использоваться качественная (одобрен-отклонен), либо количественная (бальная, процентная) шкалы. Выбор типа шкалы не имеет большого значения. Тут как удобно.
Ошибочно считать, что количественная шкала менее субъективная. Субъективность зависит от других факторов: используемая тактика и техника оценки, комплексность показателей квалификации и т.п.
Например, может применяться 100-бальная шкала оценки, где каждому из пяти элементов первого уровня (система качества, уровень производства, контроль качества, инфраструктура, целостность данных) отдается по 20 баллов. Элементы второго уровня (внутри каждого из элементов первого уровня) оцениваются по 3-х или 5-ти бальной шкале. Соответственно, по результатам квалификации поставщик может набрать от 0 до 100 баллов. Далее их категоризация. Например, если количество баллов менее 60 – поставщик отклоняется, если от 60 до 75 – временно одобряется (до получения результатов повторной оценки через какой-то период), если от 75 до 90 – считается одобренным, а свыше 90 – не просто одобренным, но и надежным.
Критерии квалификации поставщиков
В основу квалификации закладываются требования не только к качеству закупаемой продукции, но и требования к качеству работы поставщика.
Для квалификации поставщиков активных фармацевтических субстанций (АФС) критерии оценки очевидны. Производители АФС должны подтвердить свое соответствие правилам Части 2 GMP; дистрибьюторы и посредники (они же брокеры, например, обеспечивающие мультимодальную перевозку активных субстанций) – соответствие правилам GDP для АФС. Для вспомогательных веществ не все так очевидно. Многие вспомогательные вещества альтернативны, т.е. используются не только в фармацевтической промышленности и, соответственно, применение для оценки их поставщиков всех принципов GMP/GDP может привести к тому, что фармацевтическая отрасль останется без необходимых компонентов. Именно поэтому, в пункте 5.29 GMP заявлено, что «ВСПОМОГАТЕЛЬНЫЕ ВЕЩЕСТВА и их ПОСТАВЩИКИ должны контролироваться на основе результатов ФОРМАЛИЗОВАННОЙ ОЦЕНКИ РИСКОВ ДЛЯ КАЧЕСТВА». Например, в Европейском Союзе, для этих целей в Часть 3 GMP включены руководящие указания ЕМА по формализованной оценке риска для вспомогательных веществ (версия от 19.03.2015 г.).
В государствах-членах ЕАЭС данное руководство не рассматривается в качестве полезного и пригодного для использования (собственно, повторяется история с управлением рисками для качества).
Если кратко, то руководящие указания ЕМА предполагают, что нужно (1) установить критичность вспомогательных веществ, на основании этого (2) определить желаемый уровень соблюдения правил GMP/GDP со стороны поставщика, (3) оценить его работу и по результатам (4) выбрать приемлемую стратегию контроля поставляемого сырья и его поставщиков. См. рис. 1.
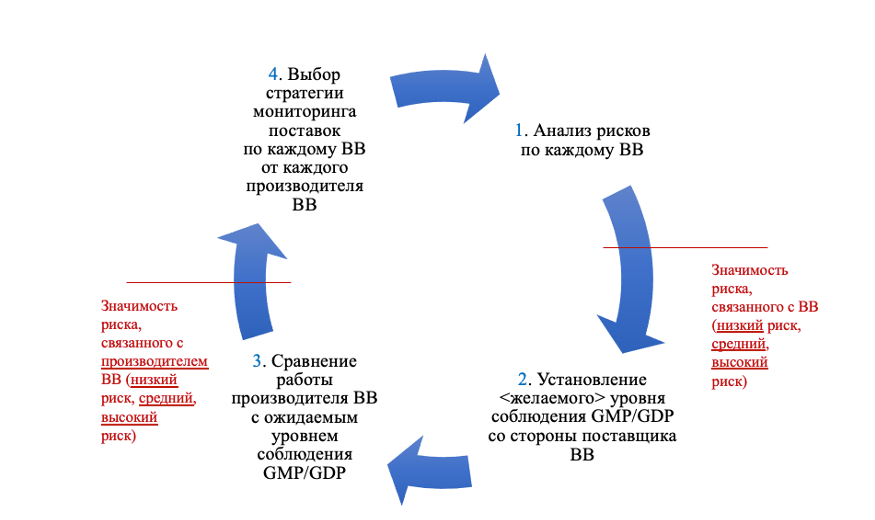
Как ранее упоминалось, на основании пункта 5.40 Части 1 GMP аналогичную модель можно применить к поставщикам упаковочных материалов.
Дополнительно, для первичных упаковочных материалов применимыми могут быть критерии, подтверждающие соответствие ISO 15378, а если упаковочный материал отнесен к категории медицинских изделий – подтверждающие соответствие ISO 13485 и т.п.
Методы квалификации
Для квалификации поставщика могут применяться документарная, удаленная и очная форма оценки. Документарная – заполнение анкеты поставщиком и (или) по данным, полученным от поставщика; изучение документации, предоставленной поставщиком (мастер-файлы, процедуры, планы и т.п.); экспертные заключения по доступной (публичной) информации и т.п. Удаленная оценка – оценка реакции на имитацию проблем; интервьюирование с помощью телекоммуникационных систем (zoom, skype, viber и др.); удаленный доступ к базам данных поставщика и т.п. Очный – как правило, очный аудит.
Выбор метода квалификации определяется уровнем общего риска, связанного как с закупаемым сырьем и (или) материалами, так и с поставщиком.
Более подробно см. статью на канале «Заочный аудит поставщика — проблемы, риски и возможности«
Повторная квалификация
Квалификация не является разовым мероприятием. Первичная квалификация поставщиков проводится для подтверждения работы по правилам GMP/GDP и достоверности предоставляемой ими информации о своей продукции и (или) деятельности. Последующая (периодическая, надзорная) квалификация проводится для подтверждения соблюдения (исполнения) взятых обязательств – соответствия сырья, неизменность процессов и (или) условий производства, своевременное уведомление об изменениях, и т.п. Соответственно, необходимо установить периодичность переоценки качества поставляемого сырья и (или) материалов и качества работы поставщика.
Период повторной квалификации зависит от нескольких факторов: (1) уровень критичности товарной позиции; (2) уровень риска, связанного с поставщиком; (3) наличие изменений; (4) результаты оценки за предыдущий период; (5) решение Уполномоченного Лица и т.п. Опять же, здесь рекомендуется применять риск-ориентированный подход. Для повторной квалификации применимы те же методы, что и для первичной квалификации. Единственное, для нее более часто применимы документарные и (или) удаленные методы оценки.
По результатам повторной квалификации либо подтверждается квалификация поставщика, либо принимается решение о его дисквалификации. Критериями дисквалификации могут быть:
- отказ поставщика от участия в оценке;
- отказ от представления необходимых данных и (или) документов;
- выявление критических расхождений и (или) отклонений, несоответствий;
- значительное ухудшение результатов квалификации (по отношению к результатам предыдущей (их) оценки(ок));
- прекращение поставок сырья и (или) материалов (например, свыше 2-3 лет)
и т.п.
Заключение
Квалификация – термин, может и не стандартизованный, но широко используемый в фармацевтической отрасли. Квалификация – это оценка, проводимая со стороны Службы качества по заранее установленным критериям к качеству деятельности поставщика.
Основной акцент квалификации – это балансирование системы закупок в соотношении «цена-качество». Квалификация — один из базовых элементов системы качества. Квалификация помогает избегать «случайных» связей, а ввязавшись – как минимум, предохраняться.
Больше информации на Telegram-канале СЛУЖБА КАЧЕСТВА
Обсуждения, дискуссии вопросы-ответы в чате специалистов по качеству
