Радиофармацевтические лекарственные препараты – лекарственные препараты, которые содержат в готовой для использования форме радионуклид (радиоактивный изотоп). Ранее использовалось сокращение РФП, сейчас утверждено сокращение РФЛП. РФЛП являются основой ядерной медицины и широко используются для диагностики и лечения различных заболеваний сердечно-сосудистой системы, почек, печени и желчных путей, щитовидной железы, скелета, легких, поджелудочной железы. Радиоизотопные методики отличаются высокой эффективностью, простотой выполнения и практически безопасны для здоровья человека. Сегодня РФЛП занимают небольшой процент от общего количества лекарственных препаратов, однако эти препараты имеют свои уникальные особенности, с которыми Вы познакомитесь в данной статье.
Настоящий материал опубликован в авторской редакции
Автор: Елена Зелинская, GMP-эксперт IBA
Материал был опубликован в журнале «Новости GMP» №2 (16) лето 2018
Классификации радиофармпрепаратов
Номенклатура РФЛП зависит от изотопов (радиоактивной метки) и от молекул, к которым идет их присоединение (синтезирование). Существуют разные классификации, в том числе в соответствии с химическим строением и многие другие. Приведем несколько классификаций.
1. По применению
РФЛП используются как для диагностики, так и для терапии. Ключевую роль играет радионуклид. Радионуклиды и соответствующие РФЛП на их основе можно классифицировать в отдельные группы см. рис. 1.
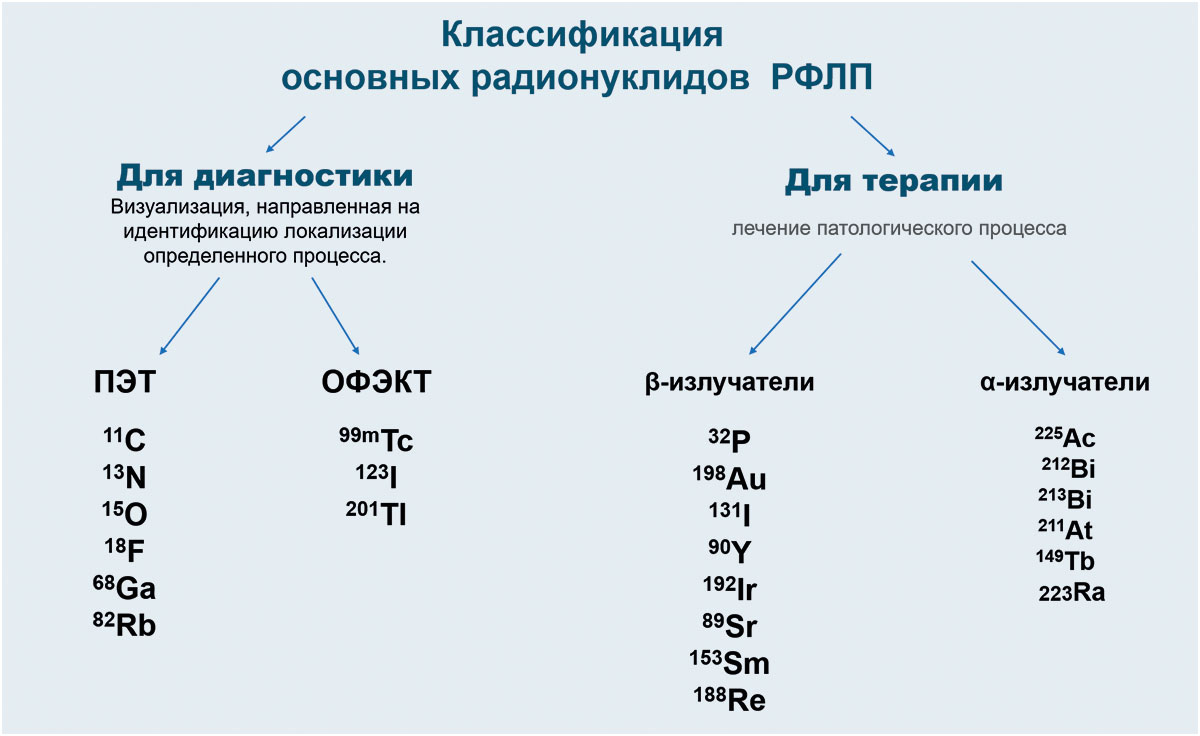
2. По сроку годности
Важным параметром является период полураспада (T ½) – это промежуток времени, в течение которого число радиоактивных ядер уменьшается вдвое. Величина периода полураспада для разных изотопов может изменяться в очень широких пределах. В соответствии с этим, радиоактивные изотопы принято делить на группы:
- Долгоживущие, T½ > 10 суток,
- Короткоживущие, T½ < 10 суток,
- Ультракороткоживущие (УКЖ), T½ < 2 часов
Период полураспада не является сроком годности препарата. Так, для препарата ФДГ (фтордезоксиглюкоза), содержащего изотоп фтор-18 (18F) с T½ =110 минут, срок годности составляет 10-12 часов.
3. По способу введения
- Парентеральный – внутривенные инъекции. Основная форма введения РФЛП.
- Энтеральный – пероральный. Используются для препаратов I-131 в виде жидкости или капсул для сканирования щитовидной железы и терапии.
- Смешанный – ингаляционный. Вентиляция лёгких пациента может быть измерена путём введения радиоактивности в форме аэрозоля, обычно Tc-99m.
Существуют различные технологии производства РФЛП. Основным компонентом любого РФЛП является радиоактивный изотоп, который можно произвести разными способами. Рассмотрим основные технологические схемы производства РФЛП.
Производство РФЛП из циклотронных радионуклидов
Номенклатура циклотронных РФЛП может доходить до 100 различных готовых лекарственных средств (ГЛС). Некоторые изотопы представлены в таблице 1.
| РАДИОИЗОТОП | ПЕРИОД ПОЛУРАСПАДА (T 1⁄2) |
|---|---|
| Фтор-18 (18F) | 110 минут |
| Углерод-11 (11C) | 20 минут |
| Азот-13 (13N) | 10 минут |
| Кислород-15 (15O) | 2 минуты |
| Галий -68 (68Ga) | 68 минут |
Каждый изотоп может использоваться для производства ряда готовых препаратов.
Например, из изотопа 18F можно произвести более 10 ГЛС. Они применяются при различных заболеваниях. Примеры представлены в таблице 2.
| НАИМЕНОВАНИЕ РФЛП | ПРИМЕНЕНИЕ |
|---|---|
| FDG (фтордезоксиглюкоза) | Скорость метаболизма глюкозы (диагностика опухолей, жизнеспособнос и миокарда, болезни Альцгеймера, эпилепсии) |
| FLT (фтор-L-тимидин) | Скорость клеточной пролиферации (агрессивность опухоли) |
| FCH (фтор-метилхолин) | Скорость синтеза фосфолипидов (диагностика рака предстательной железы и его метастазов) |
| F-MISO (фтор-мизонидазол) | Степень гипоксии тканей (диагностика опухолей) |
| F-DOPA (фтор-L-3,4-дигидроксифенил-аланин) | Концентрация дофаминовых рецепторов в головном мозге и некоторых опухолях (щитовидная, поджелудочная железа, GIST, головной мозг) |
Циклотрон-ускоритель заряженных частиц

Задача циклотрона ускорить частицу до определенной энергии, необходимой для протекания ядерной реакции. Для современных технологий достаточно циклотрона с энергией ускоряемых частиц до 18 МэВ.
Водород определенной чистоты подается в циклотрон. Генерируются ионы водорода, они ускоряются до установленной энергии. На последнем витке спирали поток отрицательных ионов проходит через графитовую пластину, которая «отбирает» электроны, и протоны направляются в мишень, где осуществляется ядерная реакция.
Мишень – это небольшая ёмкость, куда помещается стартовый материал. Стартовый материал – это химически стабильное вещество, предназначенное для облучения потоком ускоренных заряженных частиц высокой энергии. Стартовый материал может иметь газообразное, твердое, жидкое агрегатное состояние. Протоны бомбардируют стартовый материал. Суть ядерной реакции – получение одного химического элемента из другого.
Рассмотрим технологию производства РФЛП на примере ФДГ (FDG-фтордезоксиглюкоза)
В качества стартового материала используется обогащённая изотопом 18O вода (H218O). В результате бомбардирования 18O образуется радиоактивный изотоп 18F. Формула уравнения реакции: 18O(p,n)18F
Стадия наработки изотопа проходит в автоматическом режиме. Оператор находится в другом помещении и, используя программное обеспечение, удаленно контролирует процесс. Это является наилучшим решением, так как в данном случае оператор не подвергается воздействию ионизирующего излучения. Передача наработанного изотопа на стадию синтеза осуществляется удаленно в автоматическом режиме посредством трансферной линии.
В соответствии с Приложением №3 Приказа №916 Минпромторга от 14 июня 2013 г. «Об утверждении Правил организации производства и контроля качества ЛС» и Решением №77 Совета ЕЭК от 3 ноября 2016 г. «Об утверждении правил надлежащей производственной практики ЕАЭС» на продукцию циклотронов не распространяются данные требования.

Однако мишень и система передачи от циклотрона к установке синтеза могут рассматриваться как первая стадия производства активных фармацевтических субстанций (АФС). В соответствии с этим на циклотрон не распространяются требования GMP, а мишень и трансферная линия попадают под требования GMP при непрерывном, едином процессе (АФС + ГЛС) получения РФЛП.
Синтез заключается в присоединении радиоактивного изотопа (метки) к химической молекуле.
Стадии процесса введения метки методом прямого нуклеофильного радиофторирования
- Сорбция [18F] фторида на анионообменной смоле
- Элюирование
- Получение реакционноспособного комплекса [18F] фторида с криптофиксом
- Упаривание растворителя
- Нуклеофильное фторирование
- Гидролиз/снятие защитных групп
- Очистка
- Нейтрализация (рН 5-7)
- Стерилизующая фильтрация
Синтезированная молекула ФДГ отличается от глюкозы только замещением гидроксильной группы второго атома углерода на атом фтора. 2-фтор, 18F-2-дезокси-D-глюкоза, введенная внутривенно, повторяет метаболический путь глюкозы, проникая из сосудистого русла в межклеточное пространство и затем в клетки, где фосфорилируется гексокиназой.
Продукт реакции – [18F] дезоксиглюкоза-6-фосфат, в отличие от фосфата глюкозы, не вступает в дальнейшие реакции и остается в клетках в течение исследования, что позволяет измерить концентрацию радионуклида 18F в ткани.
Вводимая доза определяется на основании параметров обследуемого, в среднем 370-400 МБк.

Синтез осуществляется в автоматических модулях синтеза, которые размещены в «горячих камерах» – это производственное оборудование, которое имеет свинцовую защиту от излучения и обеспечивает определенный класс «чистоты». Как правило, для этапа синтеза достаточно класса «чистоты» С.
«Горячие камеры» работают по принципу изолятора, локализуя, при необходимости, радиационную аварию. Для работы с разными изотопами предусматриваются отдельные «горячие камеры». В одной «горячей камере» можно работать с разными РФЛП на основе одного изотопа, разделив процессы по времени и соблюдая соответствующие требования GMP.
Разрешается размещение нескольких «горячих камер» предназначенных для работы с разными изотопами в одном производственном помещении, разделив процесс по времени и соблюдая соответствующие требования GMP. Однако оптимальным решением является проектирование нескольких производственных помещений для работы с разными изотопами.
«Горячие камеры» размещаются в «чистом» помещении класса С. Соответственно, перед основным производственным помещением проектируются два санпропускника К/D и D/С. Персонал выполняет все требования, которые необходимы при работе в соответствующих классах чистоты.
Со стадии синтеза в автоматическом режиме по трансфертной линии идет передача в «горячую камеру», где происходит разбавление, финишная стерилизация, фасовка и упаковка продукта. Эти процессы выполняются в классе «чистоты» А. Фасовка осуществляется, как правило, во флаконы. Возможна фасовка по индивидуальной дозе в шприцы.
Государственная фармакопея (ГФ) РФ XIII издания содержит общую статью ОФС.1.11.0001.15 «Радиофармацевтические лекарственные препараты», в которой перечислены показатели качества, которым должны соответствовать РФЛП промышленного производства и/или изготавливаемые в медицинских учреждениях:

1. Препараты промышленного производства:
- состав;
- описание;
- подлинность;
- рН;
- объёмная активность;
- радионуклидные примеси;
- радиохимическая чистота (радиохимические примеси);
- химические примеси;
- количественное определение;
- физиологическое распределение в тканях организма;
- показатели качества, характеризующие моноклональные антитела, в случае их наличия;
- бактериальные эндотоксины или пирогенность;
- стерильность;
- упаковка;
- маркировка;
- транспортирование;
- хранение;
- срок годности.
2. Препараты, изготавливаемые в медицинских учреждениях:
- состав;
- описание;
- растворимость;
- подлинность;
- прозрачность;
- цветность;
- рН;
- показатели качества, характеризующие моноклональные антитела, в случае их наличия;
- потеря в массе при высушивании;
- механические включения (видимые, невидимые);
- количественное определение;
- бактериальные эндотоксины или пирогенность;
- стерильность;
- упаковка;
- маркировка;
- транспортирование;
- хранение;
- срок годности.
Из сложившийся практики одни и те же препараты, полученные при использовании одинаковой кассетной технологии, изготавливают или производят в зависимости от того, поступает ли препарат в обращение или используется непосредственно в медицинских учреждениях. В соответствии с данной ОФС мы должны проводить разные испытания для контроля качества этих препаратов. Во всяком случае, например, показатель «потеря массы при высушивании» для ФДГ встречается не часто, тем более, что этот показатель отсутствует в частной европейской фармакопейной статье.
К сожалению, на данный момент отсутствуют частные фармакопейные статьи, хотя в Европейской фармакопее их достаточно большое количество.
В ГФ XIII присутствует фраза, которая разрешает проводить испытание на стерильность не всех выпускаемых серий, а каждой 10 серии:
Для препаратов, стерилизованных фильтрованием и/или изготовленных в асептических условиях, следует проводить испытания стерильности каждой десятой партии при условии валидации асептических зон и контроля целостности стерилизующего фильтра при производстве каждой партии. Делается акцент, что только при валидации и контроле целостности фильтров возможна данная схема. В проекте ОФС ЕАЭС данный вариант отсутствует.
РФЛП могут быть выпущены и использованы на основе оценки документации на серию до завершения всех химических и микробиологических испытаний в связи с коротким сроком годности в соответствии с Приложением № 3 Приказа №916 Минпромторга от 14 июня 2013 г. «Об утверждении правил организации производства и контроля качества ЛС» и Решением №77 Совета ЕЭК от 3 ноября 2016 г. «Об утверждении правил надлежащей производственной практики».
Данное направление быстро развивается, только в Москве работают более 5 объектов, использующих циклотрон для производства/изготовления РФЛП и еще несколько на стадии запуска. В странах ЕАЭС также расположены подобные объекты в Белоруссии, Казахстане, Армении.
Производство радионуклидных генераторов и РФЛП на основе их элюата
Радионуклидный генератор – система, содержащая фиксированный первичный радионуклид (материнский), с более длительным периодом полураспада по отношению к дочернему, в результате распада которого возникают вторичные (дочерние) радионуклиды, извлекаемые посредством элюирования и вводимые в состав РФЛП.
Статус этого продукта является спорным, так как он выходит за рамки обычного представления о ГЛС. Существует 3 комбинации регистрации производства генераторов:
- как медицинское изделие;
- как лекарственный препарат;
- двойная регистрация – сам генератор как медицинское изделие и элюат как лекарственный препарат.
Наиболее распространены генераторы хроматографического типа, в которых материнский радионуклид фиксируется на минеральном или органическом сорбенте. Обычно генератор представляет собой стеклянную колонку, наполненную сорбентом. Дочерний радионуклид элюируется подходящим растворителем (элюентом). Колонка размещается в металлическом или пластиковом корпусе, имеющем свинцовую защиту, чтобы уменьшить облучение персонала при элюировании. На выходе из колонки стоит стерилизующий фильтр.
Генераторы собираются в «чистых помещениях». Контроль качества осуществляется в соответствии ОФС.1.11.0001.15.
Генераторная система 99Mo/99mTc является наиболее широко используемой

Производство генераторов осуществляется на лицензированных (ЛС или МИ) производственных участках. Далее генераторы транспортируются в медицинские учреждения, где медицинский персонал в асептических условиях получает элюат из генератора. В связи с тем, что в качестве элюента используется изотонический раствор, мы получаем раствор заданного рН и содержащий радионуклид. Сам элюат можно использовать в качестве ГЛС, однако он имеет ограниченное применение.
На основе данного элюата (раствора натрия пертехнетата, 99mTc) можно получить более 20 готовых РФЛП вследствие реакции восстановления и образования различных комплексных соединений. Для изготовления препарата в медицинском учреждении во флакон, содержащий стерильный лиофилизат (лиофилизированную смесь нерадиоактивных компонентов), вводят определенное количество стерильного раствора натрия пертехнетата, 99mTc, полученного из генератора 99Mo/99mTc.
В результате получают стерильный и апирогенный инъекционный РФЛП. Данные лиофилизаты зарегистрированы как лекарственные средства.
| МАТEРИНСКИЙ РАДИОНУКЛИД | T1/2 | ДОЧЕРНИЙ РАДИОНУКЛИД | T1/2 | ОБЛАСТЬ ПРИМЕНЕНИЯ |
|---|---|---|---|---|
| 62Zn | 9,26 ч | 62Cu | 9,7 мин | ПЭТ |
| 68Ge | 270,8 сут | 68Ga | 68,0 мин | ПЭТ |
| 81Rb | 4,58 ч | 81mKr | 13 с | ОФЭКТ |
| 82Sr | 25,0 сут | 82Rb | 1,25 мин | ПЭТ |
| 99Mo | 66,02 ч | 99mTc | 6,01 ч | ОФЭКТ |
Для примера, приводится информация по приготовлению одного из препаратов:
Технетрил, 99mTc – лиофилизат для приготовления раствора для внутривенного введения. Препарат готовят в медицинском учреждении непосредственно перед применением. Готовый препарат представляет собой комплекс технеция-99м с 2-метоксиизобутилизонитрилом (МИБИ).
Препарат применяют для оценки перфузии миокарда при различных патологических процессах, приводящих к нарушению его кровоснабжения, а также для визуализации злокачественных новообразований легких и молочной железы.
Приготовление препарата Технетрил, 99mTc:
- 3 мл элюата из генератора технеция-99м в асептических условиях вводят с помощью шприца во флакон с лиофилизатом;
- при необходимости предварительно проводят разбавление элюата изотоническим раствором натрия хлорида до требуемой величины объемной активности;
- флакон с препаратом помещают в свинцовый контейнер и нагревают на водяной бане в течение 15 мин с момента закипания воды;
- препарат готов к применению после охлаждения содержимого флакона до комнатной температуры;
- готовый препарат, приготовленный на основе лиофилизата, содержащегося в одном флаконе, может быть использован для обследования 5 пациентов.
Срок годности лиофилизата – 1 год, препарата Технетрил, 99mTc — 5 часов со времени приготовления.
В соответствии с ГФ XIII перечень основных показателей качества, которым должны соответствовать РФЛП, изготавливаемые в медицинских учреждениях, включает:
- состав (по расчету);
- описание;
- рН;
- объёмную активность;
- радиохимическую чистоту (радиохимические примеси);
- условия хранения, включая меры предосторожности;
- срок годности.
С 2016 года в ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России проводится разработка документации по изготовлению и обеспечению качества, а также экспресс-методов контроля РХЧ, изготавливаемых на основе радионуклидных генераторов.
Реакторный метод производства РФЛП
Наряду с циклотронами для производства радионуклидов используются ядерные реакторы. В России находятся несколько ядерных реакторов на которых производятся радионуклиды для производства РФЛП (Димитровград, Томск, Обнинск). Также есть ядерные реакторы в Казахстане.

Процесс получения радионуклида в реакторе можно разделить на этапы:
- выбор подходящей мишени и режима ее облучения;
- подготовка мишени и облучение ее в реакторе. Получение изотопов производят путём облучения нейтронами обогащенного мишенного материала в ядерных реакторах. Облучаемая мишень помещается внутрь реактора и удаляется из него с помощью пневматической почты;
- переработка облученной мишени и приготовление нужного радионуклида осуществляется в «горячих камерах»;
- фасовка, упаковка;
- контроль качества и паспортизация;
- транспортировка радионуклида производителям РФЛП.
Так же, как в случае с циклотронными радионуклидами, на реакторную продукцию не распространяются требования GMP. С точки зрения фармацевтики, радионуклид имеет статус сырья. В ядерной медицине часто можно услышать термин прекурсор или радиоактивные предшественники.
Реакторные изотопы, как правило, применяются в радионуклидной терапии.
В настоящее время в Российской Федерации наиболее широко применяются РФЛП с радиоактивным изотопом йодом-131. РФЛП «Натрия йодид, 131I, раствор для приема внутрь» выпускается как для терапии, так и для диагностики заболеваний щитовидной железы. Этот препарат зарекомендовал себя не только в онкологической области, при раке щитовидной железы, но и в лечении тиреотоксикоза. Также в клиническую практику введен этот препарат в твёрдой лекарственной форме – в виде капсул.
Данные препараты производятся на лицензируемых фармацевтических предприятиях.
Вначале на предприятие поступает радиоактивное сырье, которое подвергают переработке, в некоторых случаях – очистке, доведения до необходимых кондиций, стерилизации, затем фасовке, маркировке и упаковыванию. Работы выполняются в «чистых» помещениях. Контроль качества выполняется в соответствии с ФСП и ОФС.1.11.0001.15.
РФЛП транспортируются в соответствии с требованиями радиационной безопасности в медицинские учреждения.
 Для применения некоторых препаратов, например, йода-131 необходимы специальные палаты, изолирующие пациента, чтобы не нанести вред здоровому населению.
Для применения некоторых препаратов, например, йода-131 необходимы специальные палаты, изолирующие пациента, чтобы не нанести вред здоровому населению.
Ещё одним направлением, где незаменима радионуклидная терапия, является метастатическое поражение костей, при прогрессировании многих онкологических заболеваний. Радиоактивный изотоп производится на реакторе по реакции (n,ɣ) и может быть получен двумя способами: с носителем, когда в препарате присутствуют одновременно и целевой радионуклид, и стабильные изотопы того же элемента.
Препарат без носителя преимущественно содержит радиоактивные атомы целевого радионуклида. РФЛП «Стронция хлорид, 89Sr» внесен в перечень ЖНВЛП и, благодаря длительному периоду полураспада стронция-89, доступен в отдалённых регионах страны.
Предполагается, что наибольшее применение в практике займут инновационные РФЛП на основе терапевтических радионуклидов, таких как рений-188, лютеций-177, иттрий-90 и др. Наработка этих радионуклидов осуществляется на территории РФ и они являются доступными.
Фармакопейные статьи
XIII ГФ РФ содержит одну ОФС.1.11.0001.15 «Радиофармацевтические лекарственные препараты». Отсутствуют частные статьи.
Европейская фармакопея 9.4 версия, содержит 4 общие статьи и более 65 частных статей.
Общие статьи по РФЛП:
- № 0125 «Радиофармацевтические лекарственные препараты»
- № 2.2.66 «Обнаружение и измерение радиоактивности»
- № 2902 «Химические прекурсоры для радиофармпрепататов»
- № 51900 «Экстемпоральное изготовление радиофармпрепаратов»
Фармакопея ЕАЭС планирует включить первые 3 из 4 действующих в Европе. Статью «Экстемпоральное изготовление радиофармпрепаратов» не планируют разрабатывать, хотя именно эта область наименее юридически защищена. Фармакопейный комитет ЕАЭС согласен сотрудничать при разработке частных статей. Очень важно, если на РФЛП были бы утверждены частные статьи. На данный момент складывается следующая ситуация для ПЭТ РФЛП: каждая производственная площадка, приобретая одинаковое европейское производственное оборудование и используя одинаковую кассетную производственную технологию, получая препарат под одним наименованием и одного состава, сталкивается с разработкой ФСП. В итоге получается большое количество отличающихся частных статей. Это особенно актуально, так как РФЛП, изготавливаемые непосредственно в медучреждениях, не подлежат регистрации. Есть отличия в условиях разработки препаратов с «большой фармой». Объем готовой продукции составляет несколько флаконов, финансово ПЭТ-центрам сложно нести бремя регистрационных процедур.
Статья 0125 «Радиофармацевтические лекарственные препараты» направлена на доработку и будет рассматриваться при разработке второй части первого тома Фармакопеи ЕАЭС.
Статья 2.2.66 «Обнаружение и измерение радиоактивности» размещена на сайте евразийской экономической комиссии в разделе «обсуждение завершено» с пометкой – окончание публичного обсуждения 17 декабря 2017 года.
Статья 2902 «Химические прекурсоры для радиофармпрепататов» находится в разработке.
АФС для РФЛП
Очень сложная тема, которая с трудом находит отклик в нашей стране.
В соответствии с «Приложением №3 Приказа 916 Минпромторга к правилам надлежащей производственной практики», область применения этих документов представлена в таблице 4.
| ВИД ПРОИЗВОДСТВА | НАСТОЯЩИЕ ПРАВИЛА НЕ РАСПРОСТРАНЯЮТСЯ | НЕОБХОДИМО ВЫПОЛНЯТЬ ТРЕБОВАНИЯ ГЛАВ III - IV НАСТОЯЩИХ ПРАВИЛ | |||
|---|---|---|---|---|---|
| РФЛП РФЛП для ПЭТ | Продукция реакторов и циклотронов | Химический синтез | Стадии очистки | Обработка, приготовление дозирован. | Асептическое производство или финишная стерилизация |
| Радионуклидные генераторы | Продукция реакторов и циклотронов | Технологический процесс (сборка колонки, генератора, зарядка генератора) | |||
Из таблицы видно, что глава IV Приказа № 916 (глава II, Решения №77 ЕАЭС) распространяется на РФЛП. Наименование этой главы, как мы помним, «Основные требования к активным фармацевтическим субстанциям». Далее написано, что мишень и система передачи от циклотрона к установке синтеза могут рассматриваться как первая стадия производства фармацевтических субстанций.

Производитель РФЛП должен иметь описание технологического процесса производства фармацевтической субстанции, готового лекарственного средства и указать, какие требования настоящих Правил (глава III или глава IV) распространяются на различные технологические операции.
Соответственно, НД однозначно указывают на стадию АФС.
Та же информация содержится в Европейских правилах.
В документах МАГАТЭ «Strategies for clinical implementation and quality management of Pet tracers» International atomic energy agency Vienna, 2009 IAEA тоже можно прочитать информацию о фармацевтической субстанции.
АФС нужно вносить в Российский реестр, если она идет на реализацию. (Статья 33, 34 – 61-ФЗ РФ)
В соответствии с 61-ФЗ РФ при изготовлении лекарственных препаратов используются фармацевтические субстанции, включенные в государственный реестр лекарственных средств. Та же информация содержится в Приказе Министерства здравоохранения РФ от 26 октября 2015 года №751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения».
Отсутствует термин изготовление АФС.
Аптечные и медицинские организации не наделены полномочиями производить фармсубстанции.
При регистрации одного и того же наименования РФЛП, в графе фармацевтическая субстанция у одних производителей указывается АФС, а у других поставлен прочерк. Таким образом складывается ситуация, что часть производителей РФЛП используют термин фармацевтическая субстанция, а часть считают данный термин неприемлемым для РФЛП.
Производство/изготовление
Парадокс заключается в том, что, используя одну и ту же технологию и оборудование, на выходе имея один и тот же препарат, к объектам могут предъявляться совершенно разные требования.
Для примера возьмём препарат Фтордезоксиглюкоза. Он широко распространен как в России, так и в ЕАЭС. Однако согласно Государственному реестру лекарственных средств только 6 производителей имеют государственную регистрацию, соответственно, и лицензию на производство лекарственных средств. Остальные объекты позиционируют себя как изготовители в соответствии с 61-ФЗ РФ, где указано, что Государственной регистрации не подлежат радиофармацевтические лекарственные препараты, изготовленные непосредственно в медицинских организациях в порядке, установленном уполномоченным федеральным органом исполнительной власти.
Однако в том же 61-ФЗ РФ указано, что не допускается изготовление лекарственных препаратов, зарегистрированных в Российской Федерации.
В данной ситуации при выпуске одного и того же инъекционного, стерильного лекарственного препарата ключевым значением для качества оказывается, продается ли он или используется в том же медицинском учреждении. Если площадка позиционирует себя как ПРОИЗВОДИТЕЛИ, они вынуждены получить лицензию Минпромторга, значит, соответствовать лицензионным требованиям и зарегистрировать хотя бы часть выпускаемых препаратов.

Давайте посмотрим, каким же требованиям должны соответствовать ИЗГОТОВИТЕЛИ РФЛП.
Существует Приказ Министерства Здравоохранения РФ от 27 апреля 2015 г. №211н «Об утверждении порядка изготовления РФЛП непосредственно в медицинских организациях», данный документ составляет 1.5 страницы текста, где прописаны требования очень общими формулировками. Отсутствует практика проверки государственными органами исполнения этого документа.
Существует мнение – что изготовление РФЛП можно регулировать лицензированием медицинской деятельности, так как ПЭТ-центры являются частью медицинского учреждения. Однако документ, который регламентирует этот вид деятельности (Постановление Правительства РФ от 16.04.2012 №291 «О лицензировании медицинской деятельности»), не учитывает характер процессов, осуществляемых при изготовлении РФЛП.
Второй вариант – получение лицензии на фармацевтическую деятельность. Это вариант наиболее близок по сути, однако Приказ Министерства здравоохранения РФ от 26 октября 2015 года №751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность» также не адаптирован к процессам изготовления РФЛП.
В Европе введен термин Good Radiopharmacy Practice – надлежащая радиофармацевтическая практика и разработан ряд документов, некоторые из них приведены в списке литературы.
Можно сделать вывод:
- Изготовление РФЛП – лицензируемый и контролируемый вид деятельности. Наиболее грамотным вариантом на сегодняшний день является получение лицензии Минпромторга на производство ЛС, тем самым подтверждая условия изготовления. На данный момент требования по производству ЛС наиболее адаптированы к процессам изготовления РФЛП.
- Минимальными требованиями являются получение лицензии на фармацевтическую деятельность. НД на законодательном уровне нуждается в адаптировании требований к процессам изготовления РФЛП.
- Изготовители не имеют права производить АФС. Они должны пользоваться внесёнными в реестр ЛС. В соответствии с тем, что процесс изготовления РФЛП единый и состоит из этапов АФС + ГЛС данный процесс в соответствии с 61-ФЗ попадает под категорию ПРОИЗВОДСТВО.
- Можно разработать список препаратов, для которых не будет выделяться стадия АФС, они будут разрешены для изготовления в медицинских организациях в соответствии с правилами изготовления.
- Наличие в реестре ЛП, зарегистрированного как произведённый, попадает под категорию ПРОИЗВОДСТВО.
Требования радиационной безопасности
Работа с РФЛП жестко контролируется требованиями по радиационной безопасности (РБ). Данная деятельность лицензируется Ростехнадзором. Разработан ряд нормативных документов, часть из них приведена в списке литературы к данной статье.
Все радионуклиды, циклотронного или генераторного происхождения и, соответственно, РФЛП, относятся к открытым источникам ионизирующего излучения.
Существуют ряд требований РБ, которые отличаются от GMP правил или накладывают на них дополнительные условия. Суть требований GMP во взаимосвязи: «качественный продукт – окружающая среда» – заключается в «оберегании» продукта от воздействия окружающей среды, в том числе персонала, в то время как требования РБ заключаются в том, чтобы сберечь окружающую среду, в том числе персонал от радиоактивного продукта. Данная разница хорошо видна на каскадах давления в производственных зонах. Если по требованиям GMP в зоне, где мы работаем с продуктом, должно быть наибольшее давление, чтобы не загрязнить продукт, то по требованиям РБ, во избежание распространения возможной радиационной аварии в зоне, где мы работаем с продуктом, должно быть более отрицательное давление. Однако давно разработаны и отлажены схемы комбинирования противоположных требований.
Рециркуляция воздуха не допускается.
Необходимо наличие целого ряда разрешительных документов – санитарно-эпидемиологических заключений и лицензий на проведение работ с источниками ионизирующего излучения, а так же разрешений на вид деятельности для отдельных работников (например, для ответственных лиц по контролю радиационной безопасности, по эксплуатации комплекса, в котором содержатся радиоактивные вещества, по учету и контролю).
Необходим индивидуальный дозиметрический контроль и учёт уровней профессионального облучения персонала.
Радиационная защита от всех видов ионизирующего излучения проектируется таким образом, чтобы суммарные годовые эффективные дозы облучения не превышали 20 мЗв/год для персонала группы «А», 5 мЗв/год – для персонала группы «Б».
Данные лучевой нагрузки:
- население до 1 м3в в год (диспансеризация);
- медработники – 20 мЗв в год;
- ПЭТ с 18F 5-10мЗв;
- ОФЭКТ с Tc-99m 1-5 мЗв;
- лучевая болезнь 3-5 Зв (летальность 50%).
Выделяются контролируемая и неконтролируемая зоны по РБ. Помещения одной зоны располагаются компактно. Проектирование радиационной защиты, систем вентиляции, электроснабжения, канализации должно учитывать зонирование помещений.
Между контролируемой и неконтролируемой зонами размещается санпропускник, разделенный на «чистую» и «грязную» зоны по РБ. В состав санпропускника входят: душевые, туалетные комнаты, гардеробные, помещения для хранения средств индивидуальной защиты, пункт радиометрического контроля кожных покровов и спецодежды, кладовые грязной спецодежды и чистой спецодежды. Планировка санпропускника должна исключать возможность пересечения потоков персонала в личной и специальной одежде. Данные требования накладывают на проектирование объекта соблюдения комбинаций требований РБ и GMP для санпропускников.
При всех работах с открытыми радионуклидными источниками персонал должен использовать коллективные и индивидуальные средства радиационной защиты: защитная одежда, перчатки, удлиненные щипцы для перемещения флакона с РФЛП, защитные контейнеры для флаконов и шприцов.
Необходим контроль и учет источников излучения, и определены требования с обращением радиоактивных отходов (РАО).
Существует ряд схожих требований между системами GMP и РБ. Они обе подразумевают системы обучения и распределения ответственности персонала, документирование процессов, поточность процессов, контроль доступа в помещения, требования к производственным поверхностям, (влагостойкие, допускающие влажную уборку и дезактивацию), требования регламентированного поведения персонала в производственных зонах (запрещено принимать пищу, пить, курить, пользоваться косметикой, хранить пищевые продукты, табачные изделия, домашнюю одежду, косметические принадлежности и другие посторонние предметы) и др.
Обе системы (GMP и РБ) подразумевают формирование систем качества, которые гарантируют выполнение своих требований. Нередко на одном предприятии можно встретить две независимые системы качества. Соответственно, при инспектировании сотрудниками Ростехнадзора предоставляют Руководство по качеству в соответствии с требованиями РБ, при инспектировании сотрудниками Минпромторга предоставляют документ под таким же названием, но второе Руководство по качеству написано в соответствии с требованиями GMP. Таким образом идет задвоение целого ряда документов и процессов. Более зрелое решение – иметь единую структуру качества с объединенными процессами. Однако такие схемы реализуются редко, и возникает вопрос, кто возглавит службу качества, специалист по GMP или РБ. В любом случае, этот специалист должен иметь системный подход.
Особенности производства РФЛП
Масштаб производственного участка. Как правило, производственный участок изготавливает небольшую номенклатуру препаратов, не редкость, что это одно наименование. Объем серии исчисляется единицами, очень часто это 5-10 флаконов. Количество персонала, который работает на таких объектах редко превышает 8-9 человек, при производстве 2 серий в день. По серии в каждую смену. Соответственно, вся нагрузка по разработке ФСП, документации системы качества и т.д. накладывается на этих людей.
В соответствии с тем, что объем сырья, материалов, готовой продукции не большой, весь производственный комплекс может уместиться в 400-600 м2. Сюда входит и циклотрон, который расположен в бункере, «чистые» помещения, склады и лаборатория контроля качества.
Однако имея небольшой масштаб производственного блока, остаются все требования к производству стерильного, радиоактивного инъекционного лекарственного препарата, который выпускается до получения результатов всех испытаний по контролю качества.

Обработка контейнеров. Роль вторичной упаковки выполняет свинцовый (защитный) контейнер. Это возвратная тара. Соответственно, необходима процедура обработки контейнеров, особенно если выгрузка РФЛП осуществляется непосредственно в «чистое» производственное помещение.
Флаконы одной серии могут иметь разный объем продукта. Балк фасуется во флаконы в зависимости от заявки медучреждения. При формировании индивидуальных доз фасовка идет в зависимости от индивидуальных параметров пациента, поэтому при формировании одной серии объем продукта в разных флаконах может различаться, в соответствии с регламентном и спецификацией (СП). В СП прописываются минимальные, максимальные значения объемной активности, тем самым формируется диапазон. В связи с радиоактивной нагрузкой на персонал во флаконы для контроля качества фасуется минимальный объем, необходимый для выполнения испытаний.
«Точка пузырька». Необходимо проведение контроля целостности мембранных фильтров для инъекционных препаратов. Желательно проводить этот тест до выпуска продукции.
Маркировка первичной упаковки. Учитывая активность готовой продукции, допускается наносить маркировку на первичную упаковку до начала производства. На стерильные пустые закрытые флаконы может быть нанесена маркировка с информацией до операции наполнения, при этом стерильность не должна быть нарушена и не должно быть помех для визуального контроля наполненных флаконов.
Паспорт выписывается на конкретное время. РФЛП имеют короткий срок годности, поэтому недостаточно указывать только дату выпуска, время указывается до минут. Данное время является точкой отсчета для медицинских сотрудников, которые через некоторое время будут вводить препарат пациенту. Зная активность на определенное время, и период полураспада они смогут точно рассчитать, какое количество препарата необходимо ввести.

Специальные требования к транспортной упаковке. Предъявляются особые требования к транспортной упаковке. Используются защитные контейнеры, выполненные из свинца или вольфрама, которые помещаются в транспортный контейнер типа «A».
Контейнер оснащен воздухонепроницаемой крышкой с прокладками по периметру, предохранительными замками, рукояткой для легкой транспортировки и внутренними клапанами для компенсации давления при авиаперевозках. Внутренняя часть покрыта материалом, способным поглощать удары. Контейнер должен быть спроектирован в соответствии с требованиями, предъявляемым к перевозке жидкостей (в том числе воздушным транспортом). Контейнеры должны пройти успешно испытания по перевозке радиоактивных материалов и иметь сертификацию на конструкцию и на перевозку упаковок типа «А».
Возвращенная продукция. Не допускается переработка возвращенной продукции, с ней следует обращаться как с радиоактивными отходами.
Отзыв продукции. Отзыв продукции происходит крайне редко. Препарат используется в короткий период. При необходимости производитель должен информировать ответственный персонал медицинской организации. Для содействия этому должна быть обеспечена прослеживаемость в отношении радиофармацевтических лекарственных средств.
Особенности инспектирования объектов по производству РФЛП
Инспектора ФБУ «ГИЛС и НП» в 2017 году прошли обучение по проведению аудита производителей РФЛП. В статье приводятся несколько моментов.
Производство радиофармацевтических лекарственных средств должно выполняться в соответствии с требованиями норм радиационной безопасности. Это одно из требований Приложения №3 Приказа №916 Минпромторга. Каким образом инспектор по GMP сможет проверить данный пункт правил? GMP инспектора не обязаны знать все требования по РБ. В данной ситуации предлагается запрашивать у проверяемого объекта лицензию Ростехнадзора, органа, который отвечает за эту сферу деятельности.
 Использование калибровочных источников. Используются калибровочные образцовые спектрометрические гамма-источники (ОСГИ). Они применяются в качестве рабочих эталонов для калибровки измерительных приборов. Вид калибровочного источника определяется типом оборудования, который используется. В методике калибровки указано, какие калибровочные источники используются для данного вида оборудования.
Использование калибровочных источников. Используются калибровочные образцовые спектрометрические гамма-источники (ОСГИ). Они применяются в качестве рабочих эталонов для калибровки измерительных приборов. Вид калибровочного источника определяется типом оборудования, который используется. В методике калибровки указано, какие калибровочные источники используются для данного вида оборудования.
Как правило, калибровочный источник представляет собой плоское алюминиевое кольцо с диаметром 25 мм и толщиной 3 мм. Активная часть в источнике термически загерметизирована между двумя полиамидными пленками.
Использование радиоактивных детекторов. Для РФЛП помимо подтверждения подлинности и примесей по основной молекуле необходимо подтвердить радиохимическую чистоту и примеси.
Радиохимическая чистота − РХЧ (Radiochemical purity) – отношение активности радионуклида, который присутствует в препарате в устойчивой химической форме основного вещества, к общей активности радионуклида в этом препарате, выраженное в процентах.
Радиохимические примеси – РХП (Radiochemical impurities) − примеси химических соединений, отличных от основного вещества, составляющего препарат, но содержащих тот же радионуклид. Величину радиохимических примесей, т.е. активность содержащегося в них радионуклида, выражают в процентах к общей активности радионуклида в препарате.

Например, испытания на РХЧ проводят методом ВЭЖХ. Препарат хроматографируют с помощью детектора радиоактивности, определяя площади пиков препарата и радиохимических примесей. Соответственно, помимо ВЭЖХ необходим детектор радиоактивности.
Данные измерения можно отнести к перечню измерений, относящихся к сфере государственного регулирования обеспечения единства измерений, выполняемых при осуществлении деятельности в области здравоохранения, соответственно, эти приборы требуют поверки.
Детекторы радиоактивности и ВЭЖХ производятся разными производителями. Как правило, поверка (калибровка) осуществляется по отдельности, а квалификация должна проводиться всей системы.
Механические включения. Несмотря на статьи ОФС.1.4.2.0005.15, ОФС.1.4.2.0006.15, производители инъекционных РФЛП не всегда включают показатель механические включения в СП и ФСП на продукт.
Квалификация трансферной системы от циклотрона до модулей синтеза. В соответствии с Приказом № 916 Минпромторга РФ от 14.06.13 «Об утверждении Правил организации производства и контроля качества ЛС» и Решением Совета ЕЭК от 3 ноября 2016 г. № 77 «Об утверждении правил надлежащей производственной практики ЕАЭС», мишень и система передачи от циклотрона к установке синтеза могут рассматриваться как первая стадия производства активных фармацевтических субстанций. В соответствии с этим желательно проводить квалификацию трансферной системы от циклотрона до модулей синтеза.
Квалификация системы подачи и распределения газа. Передавливание полупродуктов по трансферной линии осуществляется газами. Необходимо разработать СП и определить требования к газам. В связи с тем, что идет непосредственный контакт с продуктом, необходима квалификация системы.
Система дератизации. В связи с тем, что ПЭТ-центры, как правило, являются частью медицинского учреждения, а также свою роль играет мнение, что радиоактивность губительна для организмов, систему дератизации, как правило, недооценивают.
Входной контроль. В связи с тем, что часто используются кассетные технологии, объем сырья и материалов не большой, не проектируются помещения для отбора проб. Как правило, отбор проб происходит в складском помещении. Отбираются целые единицы, без вскрытия упаковки.
Выпуск до получения всех результатов QС. В соответствии с правилами производственной практики РФЛП могут быть выпущены и использованы на основе оценки документации на серию до завершения всех химических и микробиологических испытаний. Оформление разрешения на выпуск может быть выполнено в 2 и более этапов до и после завершения аналитического контроля в полном объеме. Данный процесс должен быть четко определен и регламентирован.
Фармаконадзор. Как правило, система фармаконадзора не сформирована в полном объеме. Не всегда сформировано понимание, кто отвечает за данную систему.
Система маркировки и мониторинга лекарственных препаратов
В связи с принятием новой редакции Федерального закона №61 «Об обращении лекарственных средств» (ред. от 28.12.2017), в которую внесена статья 67 «Информация о лекарственных препаратах. Система мониторинга движения лекарственных препаратов для медицинского применения», в соответствии с частью 4 статьи 67 предусматривается обязательное нанесение на упаковку лекарственного препарата средства идентификационных данных, с последующим занесением их (часть 7, статьи 67) в систему мониторинга движения лекарственных препаратов для медицинского применения. В соответствии с частью 4 статьи 67 из обязательной маркировки исключены РФЛП, не подлежащие государственной регистрации.
В настоящее время в России производится целый ряд РФЛП, зарегистрированных в установленном порядке и имеющих регистрационные удостоверения. В соответствии с принятой редакцией № 61-ФЗ зарегистрированные РФЛП подлежат обязательной маркировке.
Понимая значимость системы мониторинга движения лекарственных препаратов, данные цели в области производства РФЛП достигаются другими методами:
- Производство осуществляется по предварительным заявкам-заказам от медицинской организации.
- Серия продукции составляет от 5 до 150 шт. Упаковка, как правило, производится вручную.
- Обращение РФЛП регулируется Федеральной службой по экологическому, технологическому и атомному надзору (Ростехнадзор).
- К транспортировке РФЛП предъявляются специальные требования в соответствии с НП-053-16 «Правилами безопасности при транспортировании радиоактивных материалов».
- При введении в гражданский оборот все виды РФЛП не подлежат реализации через аптечные сети и от производителя поступают непосредственно в специализированные отделения лечебных учреждений.
Введение обязательной маркировки и мониторинга для РФЛП, производство которых является мелкосерийным, может увеличить радиационную нагрузку на персонал, усложнить процесс приемки препарата в специализированных отделениях лечебных учреждений и значительно увеличить себестоимость РФЛП ввиду возможных поломок маркировочного оборудования в поле воздействия ионизирующего излучения.
Эта информация является обоснованием для введения особых условий маркировки и мониторинга для зарегистрированных РФЛП.
Данная позиция поддерживается Минпромторгом и Росздравнадзором. Осенью ждем внесения поправок в НД РФ и исключение произведённых РФЛП из системы маркировки и мониторинга лекарственных препаратов.
Заключение
Недавно на Всероссийском научно-образовательном конгрессе «Онкорадиология, лучевая диагностика и терапия» была озвучена следующая информация, что 10 лет назад в России было всего 9 объектов выпускающих РФЛП, на сегодняшней день их более 60.
Это яркий пример, что данная область быстро развивается. Возможно, через несколько лет каждый житель после 40 лет будет делать ПЭТ/КТ исследование в качестве ранней диагностики, как это уже работает в других странах, как мы сейчас делаем флюорографию во время ежегодной диспансеризации.
Сейчас в России насчитывается более 600 заводов, выпускающих фармацевтическую продукцию, на данный момент РФЛП составляет небольшой процент от всей фармацевтической индустрии, возможно, еще через 10 лет РФЛП будет занимать 40%, а может, и 45% всего фармацевтического рынка.
Автор выражает благодарность в предоставлении материалов:
- ООО «Ион Бим Аппликэйшнс», «Ай.Би.Эй.» (IBA LLC);
- ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России;
- Завод «Медрадиопрепарат» филиал ФГУП «Федеральный центр по проектированию и развитию объектов ядерной медицины» ФМБА России;
- АО «НИФХИ им. Л.Я. Карпова»
Список литературы:
- Федеральный закон № 61-ФЗ от 12.04.2010 «Об обращении лекарственных средств»;
- Приказ Министерства промышленности и торговли Российской Федерации от 14 июня 2013 г. № 916 «Об утверждении Правил организации производства и контроля качества лекарственных средств»;
- Решение Совета Евразийской Экономической Комиссии от 3 ноября 2016 г. № 77 «Об утверждении правил надлежащей производственной практики Евразийского экономического союза»;
- ОФС.1.11.0001.15 Радиофармацевтические лекарственные препараты. ГФ 13;
- ОФС.1.4.2.0005.15 «Видимые механические включения в лекарственных формах для парентерального применения и глазных лекарственных формах»;
- ОФС 1.4.2.0006.15 «Невидимые механические включения в лекарственных формах для парентерального применения»;
- Кодина Г.Е., Красикова Р.Н. «Методы получения радиофармацевтических препаратов и радионуклидных генераторов для ядерной медицины» Издательский дом МЭИ, 2014;
- Кодина Г.Е., Малышева А.О., «Контроль качества радиофармацевтических препаратов в медицинских организациях, разработка и регистрация лекарственных средств», февраль №1 (18) 2017 г.;
- Приказ Министерства здравоохранения РФ от 27 апреля 2015 г. №211н «Об утверждении порядка изготовления радиофармацевтических лекарственных препаратов непосредственно в медицинских организациях»;
- Постановление Правительства РФ от 22 декабря 2011г. №1081 «О лицензировании фармацевтической деятельности»;
- Приказ Министерства здравоохранения РФ от 26 октября 2015 г. №751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию»;
- Постановление Правительства РФ от 16.04.2012 № 291 «О лицензировании медицинской деятельности»;
- СП 2.6.1.2612-10 «Основные санитарные правила обеспечения радиационной безопасности» (ОСПОРБ 99/2010);
- СанПин 2.6.1.2523-09 «Нормы радиационной безопасности» (НРБ-99/2009);
- СанПиН 2.6.1.3288-15 «Гигиенические требования по обеспечению радиационной безопасности при подготовке и проведении позитронной эмиссионной томографии»;
- European Pharmacopoeia, Ph. Eur.9.4.;
- Rogier Langea, Rob ter Heinea, Clemens Decristoforoe «Untangling the web of European regulations for the preparation of unlicensed radiopharmaceuticals: a concise overview and practical guidance for a risk-based approach» Nuclear Medicine Communications 2015;
- «Good practice for introducing radiopharmaceuticals for clinical use» INTERNATIONAL ATOMIC ENERGY AGENCY, Vienna, 2016;
- «Strategies for clinical implementation and quality management of pet tracers» IAEA Vienna, 2009;
- «Cyclotron Produced Radionuclides: Guidance on Facility Design and Production of [18F]Fluorodeoxyglucose (FDG)» IAEA Vienna, 2012;
- Guidance on current good radiopharmacy practice (cGRPP) for the small-scale preparation of radiopharmaceuticals 2010, EANM Radiopharmacy Committee;
- «Guidelines on current good radiopharmacy practice (cgrpp) in the preparation of radiopharmaceuticals» cGRPP-guidelines, 2007 EANM Radiopharmacy Committee.
- http://amplituda.ru/
