Резистентность бактерий к лекарственным средствам для медицинского применения и ветеринарным лекарственным средствам является нарастающей медицинской проблемой в Европейском Союзе и на международном уровне. Применение противомикробных лекарственных средств, которые применяются у животных, может ускорить появление и распространение резистентных микроорганизмов, а также снизить эффективное применение уже ограниченного числа существующих противомикробных лекарственных средств для лечения инфекций у человека. Усиление разумного использования противомикробных лекарственных средств в Европейском союзе привело к увеличению интереса к использованию аутогенных вакцин.
Что такое аутогенные вакцины для ветеринарного применения?
Аутогенная вакцина для ветеринарного применения — это вакцина, приготовленная с использованием микроорганизмов, которые выделены из того же инфицированного животного, которому она затем вводится.
Сегодня мировые компании-производители ветеринарных лекарственных средств обеспечивают аутогенными вакцинами животноводческие хозяйства по всему миру.
Преимущества аутогенных вакцин
Предотвращение, а не лечение:
- ограничение частоты заболевания;
- борьба с мультирезистентными бактериями.
Это функция каждой вакцины; развитие бактериальной резистентности отменяет вариант лечения антибиотиками.
Вклад в общественное здравоохранение:
- снижение выделения микробных токсинов, вызывающих инфекцию;
- ограничение использования антиинфекционных агентов.
Пищевая промышленность обязана защищать здоровье потребителей.
Предоставление решений там, где нет вакцин:
- вакцинация в срочном порядке в случае возникновения заболеваний;
- предложение решений для заболеваний, описываемых как «незначительные», и для видов, обозначенных как «вторичные».
Время и затраты на разработку коммерческой вакцины иногда несовместимы с требованиями тех, кто работает на местах и на целевых рынках.
Получение специфического иммунитета:
- борьба с неудачной вакцинацией.
Антигенная вариабельность в пределах одного и того же вида бактерий, даже в пределах одного и того же серотипа, такова, что полная защита часто непредсказуема, когда вакцинальный антиген отличается от агрессора.
Снижение затрат на производство:
- ограничение числа вакцинных вмешательств, путем комбинирования несколько валентностей;
- разработка инновационных лекарственных форм, которые снижают вмешательство человека.
Стоимость обращения с животными и связанные с этим неудобства для тех, кто в это вовлечен, а также стресс, причиняемый самим животным, требуют принятия обязательства упростить планы по профилактике. Число инъекций можно уменьшить, путем комбинирования несколько валентностей. В некоторых случаях можно получить отличную защиту при однократном введении, в результате разработки высокоэффективных адъювантов. При определенных показаниях могут использоваться аутогенные вакцины, адаптированные для перорального применения [1].
Процесс разработки аутогенных вакцин
Ветеринар берет образец у больного животного или во время вскрытия, который он отправляет в диагностическую лабораторию для культивирования. В лаборатории патогенный агент выделяют, идентифицируют и серотипируют с использованием реагентов, производимых компанией-производителем ветеринарных лекарственных средств. Далее ветеринар заказывает производство аутогенной вакцины из выделенного штамма, который затем отправляется компании-производителю. Аутогенная вакцина, произведенная компанией-производителем за несколько недель в зависимости от ее состава, доставляется ветеринару, который выдает ее своему клиенту. Компания-производитель также может помочь ветеринарам разработать программу вакцинации.
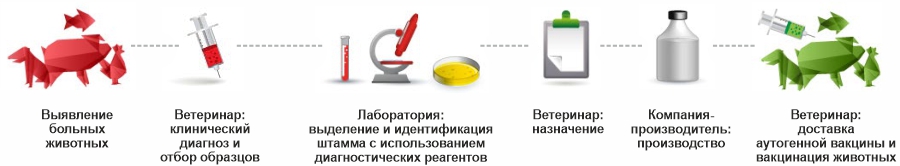
Благодаря своим продуктам и услугам, компания-производитель может предложить комплексное и индивидуальное решение для сектора животноводства и ветеринарии.
Аутогенные вакцины, произведенные в современных биотехнологических установках в соответствии с высокими стандартами стерильности, могут использоваться по нескольким показаниям и предназначены для многих видов животных, начиная от домашнего скота и заканчивая домашними животными [1].
Регулирование обращения аутогенных вакцин в ЕС
В настоящее время в ЕС нет согласованных требований к производству, контролю и применению аутогенных вакцин. Национальные законы и/или законодательные акты различны, если они существуют, и иногда не существует специального законодательства, касающегося использования и производства аутогенных вакцин.
Директива Европейского парламента и Совета Европейского Союза 2001/82/EC от 6 ноября 2001 года «О кодексе Сообщества в отношении ветеринарных лекарственных средств» с внесенными в нее поправками, регулирует производство, контроль, вывод на рынок, импорт, экспорт, поставку, использование и фармаконадзор за иммунологическими лекарственными средствами для ветеринарного применения. Это гарантирует качество ветеринарных лекарственных средств, произведенных в Сообществе, путем требования соблюдения Правил надлежащей производственной практики (Good Manufacturing Practice, GMP). Каждое ветеринарное лекарственное средство должно быть авторизовано до его вывода на рынок.
Аутогенные вакцины также определены в настоящей Директиве, но исключены из сферы ее применения. Следствием этого исключения является то, что обращение аутогенных вакцин не регулируются на европейском уровне. Их качество, производство и использование зависят от национального законодательства каждого государства-члена. Законодательство об аутогенных вакцинах отличается от государства-члена к государству-члену [2, 3].
С января 2022 года будут применяться новые положения, когда Регламент (ЕU) 2019/6 Европейского парламента и Совета Европейского Союза от 11 декабря 2018 года «О ветеринарных лекарственных средствах и отмене Директивы 2001/82/EC» фактически заменит Директиву 2001/82/EC. С этого времени обращение ветеринарных лекарственных средств будет регулироваться только Регламентом (ЕU) 2019/6.
Ряд статей настоящего Регламента также применим к инактивированным иммунологическим лекарственным средствам для ветеринарного применения, которые изготавливаются из патогенов или антигенов, получаемых от животного или животных в эпидемиологической единице и применяемым для лечения этого животного или животных в той же эпидемиологической единице, или для лечения животного или животных в единице, имеющей подтвержденную эпидемиологическую связь.
Без ущерба для даты применения настоящего Регламента, обязательства, касающиеся сертификатов Надлежащей производственной практики на иммунологические лекарственные средства для ветеринарного применения, которые производятся из патогенов и антигенов, получаемых от животного или животных в одной и той же эпидемиологической единице или для лечения животного или животных в определенной единице, имеющей подтвержденную эпидемиологическую связь, должны начать применяться только с даты применения исполнительных актов, устанавливающих особые меры по Надлежащей производственной практике для этих лекарственных средств.
Эти специальные GMP-рекомендации для аутогенных вакцин, тем не менее, все еще должны быть подготовлены [2, 4].
Регулирование обращения аутогенных вакцин во Франции
Во Франции регулирование обращение аутогенных вакцин определено в следующих документах
Кодекс общественного здравоохранения (Code de la santé publique)
Статья L5141-2: «Аутогенные вакцины для ветеринарного применения — это любые иммунологические лекарственные средства для ветеринарного применения, изготовленные с целью получения активного иммунитета от патогенных организмов, полученных от животного или животных из того же стада, которые были инактивированы и использованы для лечения этого животного или животных из этого стада».
Статья L5141-12: «Приготовление аутогенных вакцин для ветеринарного применения должно осуществляться уполномоченным лицом (personne qualifiée) или компанией или организацией, в которой работает уполномоченное лицо, получившее для этой цели лицензию, выданную Национальным агентством по контролю в области санитарной безопасности продуктов питания, окружающей среды и труда (l’Agence nationale chargée de la sécurité sanitaire de l’alimentation, de l’environnement et du travail — ANSES) » [1, 5].
Распоряжение №2005-374 от 20 апреля 2005 года об аутогенных вакцинах для ветеринарного применения в поправках к Кодексу общественного здравоохранения — нормативная часть (Décret n° 2005-374 du 20 avril 2005 relatif aux autovaccins à usage vétérinaire et modifiant le code de la santé publique — partie réglementaire)
Статья 5141-129: «Приготовление аутогенных вакцин осуществляется под ответственность уполномоченного лица, получившего лицензию, предусмотренную в статье L5141-12, …)»; «Уполномоченное лицо — фармацевт или ветеринар. …»; «Уполномоченное лицо прошло профессиональную подготовку или имеет профессиональный опыт в области иммунологии или производства лекарственных средств. Он или она выполняет свои функции лично. Он или она контролирует деятельность, связанную с приготовлением, хранением, транспортировкой и мониторингом аутогенных вакцин для ветеринарного применения в соответствии с Надлежащей Практикой, что определено приказом министров, ответственных за сельское хозяйство и здравоохранение, изданного по предложению генерального директора Национальным агентством по контролю в области санитарной безопасности продуктов питания, окружающей среды и труда».
Статья R5141-141: «Держатель разрешения, предусмотренного в статье L5141-12, может поставлять аутогенную вакцину для ветеринарного применения только назначающему ветеринару или любому другому ветеринару, который предоставил при включении в заказ тот же служебный адрес, что определено в статье R242-52 Кодекса сельского хозяйства (Code rural)» [1, 6].
Гармонизация правовой базы для аутогенных вакцин в ЕС
EMAV — Ассоциация европейских производителей аутогенных вакцин и сывороток представляет ведущих европейских производителей данных лекарственных средств, таких как AniCon Labor, Ceva Sante Animale, IDT Biologika, Vaxxinova и др.
EMAV объединяет интересы производителей специфических вакцин и сывороток для сельскохозяйственных, домашних и экзотических животных для того чтобы способствовать европейскому процессу гармонизации.
Члены EMAV в настоящее время работают в разных национальных системах, определяющих местонахождение их объектов. Они хотели бы привнести свой многолетний опыт в процесс гармонизации, особенно путем разработки будущего стандарта GMP, специфичного для аутогенных вакцин [7].
Аутогенные вакцины в России
На сегодняшний день в России отсутствует регулирование в сфере обращения аутогенных вакцин. В первую очередь, в нашем законодательстве не прописана сама процедура регистрации этого типа вакцин. Тем не менее, данное направление могло бы быть интересно как животноводческим хозяйствам, так и производителям ветеринарных лекарственных средств.
«Перспективное направление — производство аутогенных вакцин, использование которых пока в России не регламентировано. Суть в том, что выделяется локальный для конкретного предприятия, например для птицефабрики, микроорганизм, культивируется, изучается, а затем все поголовье вакцинируется. В Европе аутогенные вакцины готовятся по регламенту Евросоюза, их не нужно регистрировать, но можно использовать только на том предприятии, где выделен микроорганизм. Думаю, у этого направления хорошее будущее, так как аутогенная вакцина в определенном смысле — альтернатива антибиотикам, использование которых необходимо снижать», — сказал недавно директор Федерального центра охраны здоровья животных (ФГБУ «ВНИИЗЖ») Дмитрий Лозовой в интервью, данном федеральной отраслевой газете «Ветеринария и жизнь» [8].
В определенных ситуациях, аутогенные вакцины для ветеринарного применения, соответствующие основным требованиям к качеству и безопасности, могут быть очень полезным инструментом в управлении здоровьем и благополучием животных. В Российской Федерации, изучение опыта ведущих европейских производителей ветеринарных лекарственных средств может быть первым шагом в этом направлении.
Автор материала: Константин Морозов,
специалист по надлежащей производственной практике ООО «Сева Санте Анималь»
Ссылки:
- Ceva Biovac. Autogenous Vaccines. URL: https://www.biovac.ceva.com/en/Autogenous-vaccines/Autogenous-Vaccines (дата обращения 22.01.2020)
- Lohmann Tierzucht. Brigitte Othmar-Vielitz. Autogenous veterinary vaccines. URL: http://www.ltz.de/en/news/lohmann-information/2019-1/4_Autogenous_veterinary_vaccines.php (дата обращения 22.01.2020)
- Directive 2001/82/EC of the European Parliament and of the Council of 6 November 2001 on the Community code relating to veterinary medicinal products. URL: https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=CONSLEG:2001L0082:20090807:EN:PDF (дата обращения 22.01.2020)
- Regulation (EU) 2019/6 of the European Parliament and of the Council of 11 December 2018 on veterinary medicinal products and repealing Directive 2001/82/EC (Text with EEA relevance). URL: https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32019R0006&from=EN (дата обращения 22.01.2020)
- Code de la santé publique. URL: https://www.legifrance.gouv.fr/affichCode.do?cidTexte=LEGITEXT000006072665&dateTexte=20200109 (дата обращения 22.01.2020)
- Décret n° 2005-374 du 20 avril 2005 relatif aux autovaccins à usage vétérinaire et modifiant le code de la santé publique (partie réglementaire). URL: https://www.legifrance.gouv.fr/affichTexte.do?cidTexte=JORFTEXT000000448515&categorieLien=id (дата обращения 22.01.2020)
- Association of European Manufacturers of Autogenous Vaccines and Sera. Principles. URL: https://www.emav.be/en/pages/show/principles (дата обращения 22.01.2020)
- Ветеринария и жизнь. Курица или яйцо? Что нужно для выполнения планов по импортозамещению и экспорту продовольствия. URL: https://www.vetandlife.ru/vizh/mneniya/kuritsa-ili-yaytso-chto-nuzhno-dlya-vypo/ (дата обращения 22.01.2020)
