«Государственный институт лекарственных средств и надлежащих практик» (ФБУ «ГИЛС и НП») как представитель российского государственного GMP-инспектората, уполномоченный Минпромторгом России на проведение инспекций иностранных производителей лекарственных средств на соответствие стандартам надлежащей производственной практики, недавно провел первую дистанционную GMP-инспекцию производственной площадки, принадлежащей международной фармацевтической компании. Введенные в связи с COVID-19 ограничительные меры «социального дистанцирования» ограничивают число персонала на производственных площадках, что требует альтернативного подхода. В данной статье представлен опыт обеих сторон, чтобы дать рекомендации как производителям, так и регуляторным органам во всем мире, о мере перехода к данной новой форме инспектирования (1).

Многие регуляторные органы отложили или полностью прекратили проведение инспектирования в связи с пандемией COVID-19 (2-5). Альтернативные методы инспектирования были предложены как PIC/S, так и FDA, использующих дистанционные аудиты, в качестве исключительной временной меры во время карантина COVID-19, и ограничения на передвижение (6,7).
ФБУ «ГИЛС и НП» быстро адаптировался к текущей ситуации, чтобы избежать дефицита лекарственных средств, предложив временно проводить инспектирование иностранных производителей лекарственных средств дистанционно. Такой подход предполагает тщательную проверку представленной документации и оценку рисков на производственной площадке. Внутренние процедуры инспектората были пересмотрены с целью включения в них подробного описания процесса инспектирования на основе документов, представленных производителем лекарственных средств.
Руководство ФБУ «ГИЛС и НП» должно предоставить разрешение на проведение дистанционного инспектирования. Решение о дальнейших действиях основывается на риск-ориентированном подходе, с учетом множества факторов, таких как результаты предыдущих инспекций, сложность площадки и критичность производимой продукции (7). Например, если площадка получила GMP сертификат после предыдущей инспекции ФБУ «ГИЛС и НП», орган может разрешить провести инспекцию дистанционно, которая даже позволит включить новую продукцию в ранее выданный GMP сертификат. Однако если в ходе предыдущей инспекции были выявлены критические замечания, то повторная документарная инспекция будет включать подробное рассмотрение корректирующих действий, в том числе пересмотр документов, отчетов валидации и подтверждение обучения персонала. Решение о проведении дистанционного инспектирования должно быть задокументировано в виде протокола. В соответствии с этим новым подходом, представители производственной площадки, подлежащей инспектированию, также должны предоставить письменное подтверждение, что они согласны на удаленное инспектирование.
Для начала, за 10 рабочих дней до инспекции, ФБУ «ГИЛС и НП» отправляет иностранному производителю лекарственных средств план, включающий перечень документов, которые будут рассмотрены в рамках инспекции. Иностранный производитель лекарственных средств, как правило через своего официального представителя, передает в согласованном виде запрашиваемые документы. Обычно бумажные копии документов доставляются в ФБУ «ГИЛС и НП» представителем российского филиала, однако во время ограничений вследствие пандемии, принимаются электронные копии. (Примеры документов, запрашиваемых ФБУ «ГИЛС и НП» для дистанционной проверки, приведены в конце статьи).
В основном, запрашиваемая информация предоставляется по электронной почте или любым другим согласованным способом. Оптимальным способом передачи документов является размещение документов в «облачное хранилище», доступ к которому ограничен для конкретных участников, а также предоставляется только на время инспекции. Для проведения документарной инспекции требуется иной уровень виртуальной безопасности, поскольку документы направляются в полном их объеме, в то время как во время проведения инспекций на площадках, документы передаются только инспекторам. В случае необходимости перевода документов может потребоваться дополнительное время, особенно если перевод большого документа должен быть выполнен в установленные сроки. Комиссия инспекторов подробно изучит полученную документацию и примет решение о том, потребуются ли последующие действия. При необходимости и при согласовании сторон возможно проведение телеконференции для предоставления ответов на вопросы. Комиссия инспекторов может запросить недостающую документацию или дополнительную информацию, чтобы прояснить любые вопросы, которые могли возникнуть во время удаленной проверки.
Имейте в виду, что дистанционные инспекции неизбежно занимают больше времени, чем инспекции на площадке. Это объясняется несколькими факторами, в том числе, разными часовыми поясами и отсутствием прямого контакта инспектора с представителями площадки. При изменении формата инспектирования (на дистанционный) алгоритм инспектирования остается «классическим», т.е. первый день инспектирования начинается со вступительного совещания в форме презентации на английском языке с краткой информацией о ФБУ «ГИЛС и НП», составе комиссии и целях инспектирования. Далее инспектирование продолжается по Плану, отправленному на производственную площадку. В среднем, в отличие от выездных, дистанционные инспекции могут занять в два-три раза дольше времени от начала до завершения, т.к. во время дистанционных инспекций будут некоторые перерывы по мере передачи и рассмотрения информации. По окончании инспектирования, комиссия инспекторов подводит итоги и знакомит с ними представителя площадки в России путем отправки информации по электронной почте и проведения заключительной встречи в формате телеконференции. Результатом инспекции является отчет, который направляется заявителю в течение тридцати дней, в соответствии с установленными законодательными актами Российской Федерации сроками.
Подход площадки к дистанционным инспекциям
Со стороны принимающих площадок, очень важно правильно подготовиться к дистанционной инспекции. Как и при традиционных выездных инспекциях, очень важно иметь интегрированный подход и внимательным образом координировать работу между российским представительством компании заявителя и принимающей производственной площадкой. Зачастую, производственные площадки международных компаний выпускают большое количество единиц продукта предназначенных для многих стран. Возможны случаи, когда производственная площадка неправильно истолковала требования российского Регуляторного досье, что может привести к возникновению дополнительных вопросов и замечаний со стороны инспекторов. До начала инспекции, необходимо провести телеконференции между сотрудниками российского отдела и производственной площадки. Это поможет производственной площадке понять содержание Регуляторного досье, а также ознакомиться с информацией по Форме 3, поданной для проведения инспекции. Пример Формы 3 приведен ниже. Кроме того, принимающая сторона должна иметь ясное понимание производственного маршрута продуктов за пределами производственной площадки, и отношения между различными юридическими субъектами, вовлеченными в производство, тестирование, выпуск, маркировку и дистрибуцию продукта в России.
Во время дистанционной инспекции необходимо наладить эффективную работу в условиях разных часовых поясов и ограниченного количества персонала на заводе, ввиду пандемии. В группу инспекционной поддержки должен входить не только персонал производственной площадки, но и представитель площадки в России и сотрудников, ответственных за качество выпускаемой продукции для уточнения местных требований и ответов на вопросы, связанные с конкретным типом продукции или нормативными документами (НД). Представители производителя в России играют особенно важную роль в дистанционной инспекции, так как отсутствует личный контакт между инспектором и принимающей производственной площадкой, и российские представители играют роль «моста» между принимающей площадкой и группой инспекторов. Данный представитель должен способствовать установлению положительных рабочих отношений с инспекторами. Все запросы и уточняющие вопросы должны отправляться на русском языке представителю производителя в России, который затем организует их перевод и перенаправит производственной площадке.
Назначается координатор на принимающей производственной площадке, который получает запросы на проведение инспекций и распределяет их различным профильным экспертам. После получения соответствующих документов и/или отчетов, координатор может также отслеживать юридическую экспертизу и перевод документов. Важно предоставлять ответы в организованной форме, например, в сопровождении пояснительного письма, четко связывающего вопрос с ответом. Необходимо наладить оперативный перевод документов и сопровождающих писем. Поскольку данные шаги могут занять некоторое время, это является хорошей практикой продолжать ведение коммуникации с инспекторами с тем, чтобы они знали, что их документы рассматриваются и не проигнорированы. Представитель производителя в России может позвонить инспектору, чтобы обозначить временные рамки и ответить на какие-либо вопросы.
Недавно проведенная дистанционная инспекция показала, что российские GMP инспекторы могут запросить дополнительные разъяснения. После того, как первоначальные документы (см. таблицу в конце статьи) были рассмотрены инспекторами, были заданы уточняющие вопросы по линии, используемой для производства продукта, находящегося на стадии оценки, и был сделан запрос производственного протокола на серию. Помимо этого, были запрошены перечень несоответствий и претензий, относящихся к продукту, перечень компьютеризированных систем GMP, используемых на площадке, и титульная страница аудиторского отчета контрактной производственной площадки. Изначальный перечень включал в себя тридцать один запрос (см. таблицу ниже), и вытекающих из них еще двадцать три вопроса. После этого было получено еще пять запросов. Результатом инспекции стали два несущественных замечания.
Следует отметить, что ФБУ «ГИЛС и НП» считает проведение удаленного инспектирования вынужденной мерой, принимаемой только в отношении производственных площадок, проходящих повторную проверку. Процесс выездных инспекций будет восстановлен по окончании пандемии COVID-19. У ФБУ «ГИЛС и НП» нет типовых подходов ко всем производствам, которые просят провести проверку на соответствие GMP без выезда на саму площадку. До принятия такого решения, ФБУ «ГИЛС и НП» внимательнейшим образом изучит досье на выпускаемый заявителем препарат для оценки риска. Например, стерильное производство связано с высокими рисками, по всей вероятности, ФБУ «ГИЛС и НП» вряд ли выберет подход проведения документарной инспекции. ФБУ «ГИЛС и НП» считает, что документарная проверка все-таки содержит ряд ограничений. В целях принятия объективного решения о соответствии или несоответствии производственной площадки требованиям правил надлежащей производственной практики, с помощью документарной инспекции ФБУ «ГИЛС и НП» будет применять всеобъемлющий подход, который был разработан во время периода пандемии COVID-19.
Пандемия COVID-19 поставила производителей, представителей производственной площадки в России и инспекторов в новую и сложную ситуацию, в которой продолжение поставок медицинской продукции при продемонстрированном соблюдении, отвечает интересам общества. К счастью, недавние примеры документарной инспекции показывают, что при правильной организации и слаженной работе производственной площадки и сотрудников российского представительства успех инспекций реален и достижим.
Перечень документов по качеству, подлежащих рассмотрению во время инспекции
| № | Запрашиваемый документ |
|---|---|
| Документация системы фармацевтической системы качества | |
| 1 | Копия лицензии производственной площадки |
| 2 | Копия GMP сертификата площадки (выданного местным Уполномоченным органом) |
| 3 | CAPA для наблюдений c предыдущих инспекций |
| 4 | Описание производственного маршрута производства продукта XXX – название, адрес и стадии производства для каждой вовлеченной площадки. Информация по соглашениям в области качества между соответствующими площадками и статусу соглашений. |
| 5 | Анализ функциональности фармацевтической системы качества со стороны руководства для оценки эффективности (последний отчет) – Отчет о качестве для анализа со стороны руководства |
| 6 | Ежегодный Обзор Продукции для Продукта XXX за 2019 и процедура по созданию обзора качества (разделы: обзор качества ГЛС, обзор претензий, обзор несоответствий, обзор изменений). Процедура создания ежегодного обзора качества продукции. |
| 7 | Процедура по выпуску продукта. Список лиц, ответственных за выпуск продукции. |
| 8 | Процедура по управлению контролем над изменениями и перечень существенных изменений для Продукта XXX за 2019/2020 |
| 9 | Процедура по управлению несоответствиями и список несоответствий для Продукта XXX за 2019/2020 |
| 10 | Процедура самоинспекции. Список лиц, которые проводят самоинспекции. Информация по самоинспекциям для производственных помещений, используемых в производственном процессе Продукта XXX со статусом самоинспекции (даты, результаты, ответственные инспекторы) |
| 11 | Процедура по управлению претензиями. Перечень претензий за 2019/2020 для Продукта XXX (если применимо) |
| 12 | Процедура управлению отзывами продуктов. Перечень отзывов за 2019/2020 для Продукта XXX (если применимо) |
| 13 | Перечень утвержденных поставщиков материалов для Продукта XXX |
| 14 | Описание должностных функций ключевого персонала: Начальник производства, Начальник контроля качества |
| 15 | Подробное схематическое описание производственной площадки XXX с обозначением категорий помещений, персонала и материальных потоков, местонахождения оборудования, указанием производственной линии, используемой для производства Продукта XXX |
| 16 | Подробное схематическое описание лабораторий контроля качества, используемых для тестирования Продукта XXX |
| 17 | Подробные чертежи системы отопления, вентиляции и кондиционирования воздуха площадки производства Продукта XXX |
| 18 | Подробное схематическое описание складских помещений, используемых для производства Продукта XXX |
| 19 | Процедура по работе с промежуточными и готовыми лекарственными средствами в складских помещениях (получение, хранение) |
| 20 | Копия протокола сопровождения серии для упаковки Продукта XXX (решение о номере серии принимается на усмотрение производственной площадки) |
| 21 | Внутрипроизводственный контроль процесса производства Продукта XXX (процедура, определяющая осуществление внутрипроизводственного контроля) |
| 22 | Условия хранения для Продукта XXX (процедура, определяющая условия хранения) |
| 23 | Перечень запланированных мероприятий по валидации и квалификации на 2020 (относящиеся к оборудованию и производственным помещениям, используемым для производства Продукта XXX) |
| 24 | Отчет и протокол квалификации производственного помещения, используемого для производства Продукта XXX |
| 25 | Отчет и протокол квалификации производственной линии, используемой для производства Продукта XXX |
| 26 | Спецификация для ГЛС по производству Продукта XXX |
| 27 | Спецификация для ЖЛС (перед упаковкой) по производству Продукта XXX |
| 28 | Отчет исследования стабильности для Продукта XXX, включая данные на протяжении всего срока годности продукта. Процедура по исследованию стабильности продукта. |
| 29 | План по исследованию стабильности для Продукта XX |
| 30 | Валидация аналитических методов (или отчет передачи методов) для Продукта XXX (методы будут выбраны после получения спецификаций) |
| 31 | Процедура по управлению несоответствиями спецификаций. Перечень несоответствий спецификаций за 2019/2020 для Продукта XXX |
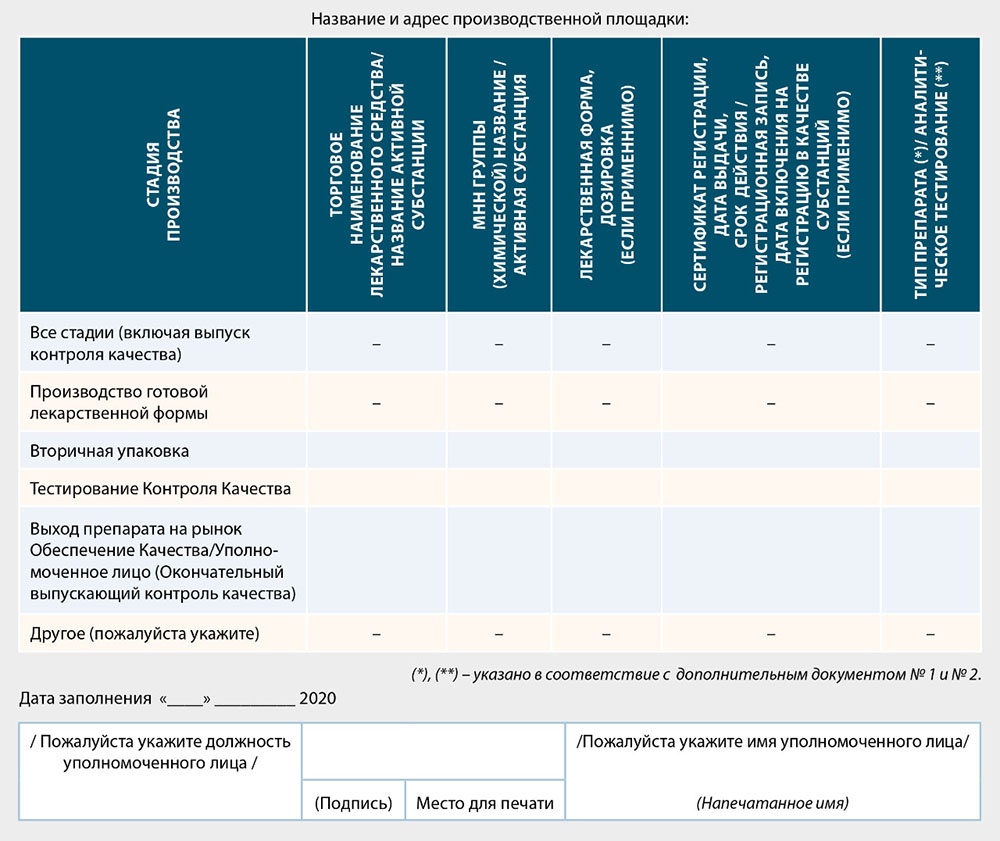
Перечень медицинских препаратов, изготовленных на производственной площадке производителя или зарубежного производителя, где будет проведена инспекция
Дополнительный документ № 1
К перечню медицинских препаратов, изготовленных на производственной площадке производителя или зарубежного производителя, где будет проведена инспекция

Дополнительный документ № 2

Оригинал статьи на английском языке:
https://www.pda.org/pda-letter-portal/home/full-article/regulator-develops-remote-inspection-process-due-to-pandemic
Ссылки:
- Федеральный закон «Об обращении лекарственных средств» от 12.04.2010 N 61-ФЗ (с изменениями от 04.03.2020) http://www.consultant.ru/document/cons_doc_LAW_99350/
- https://www.fda.gov/news-events/press-announcements/coronavirus-disease-2019-covid-19-update-foreign-inspections
- https://mhrainspectorate.blog.gov.uk/2020/03/23/mhra-good-practice-gxp-inspections-during-the-covid19-outbreak/
- https://www.sukl.sk/hlavna-stranka/slovenska-verzia/inspekcia/posobnost/vykon-inspekcii-pocas-pandemie-covid-19?page_id=5339
- Процедура инспекционного взаимодоверия от PIC/S, PIC/S Июнь 2018 г.
- MDSAP Номер пересылки: 2020-05, https://www.fda.gov/media/136441/download
- «Рекомендуемая модель планирования инспекций на основе оценки рисков в условиях GMP» от PIC/S, 1 января 2012 г.
Мнение авторов может не совпадать с мнением редакции.
Перепечатка публикации возможна только по согласованию с редакцией.