
Уходящий 2020 год был очень непростым. Он поставил серьезные вызовы перед всем фармацевтическим сообществом, в том числе перед инспекторами регуляторных органов и перед внутренними аудиторами фармацевтической системы качества. В данном небольшом обзоре представлены результаты инспектирования производителей лекарственных средств для ветеринарного применения, производство которых осуществляется за пределами Российской Федерации, на соответствие требованиям Правил надлежащей производственной практики (Good Manufacturing Practice, GMP). Эти инспекции были проведены специалистами подведомственного Россельхознадзору Федерального государственного бюджетного учреждения «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГБУ «ВГНКИ») в 2017-2020 годах. Кроме того, в обзоре представлены последние изменения и мероприятия, связанные с GMP-инспектированием.
Результаты инспектирования
Согласно реестру выданных заключений, опубликованному на сайте Россельхознадзора 16.11.2020 г. [1], в 2017-2020 годах было выдано 41 заключение о соответствии иностранных производителей требованиям Правил GMP.
Анализ результатов инспектирования за эти годы показывает следующие тренды:
- производственные площадки, расположенные в Испании, демонстрируют лучшие результаты — они получили восемь положительных заключений;
- производственные площадки, расположенные в США и Италии, показывают худшие результаты — суммарно они получили девятнадцать отказов в выдаче заключений.
- производственные площадки, расположенные во Франции, несколько улучшили свои результаты — они получили уже пять положительных заключений, хотя количество отказов этим площадкам все еще велико (пятнадцать).
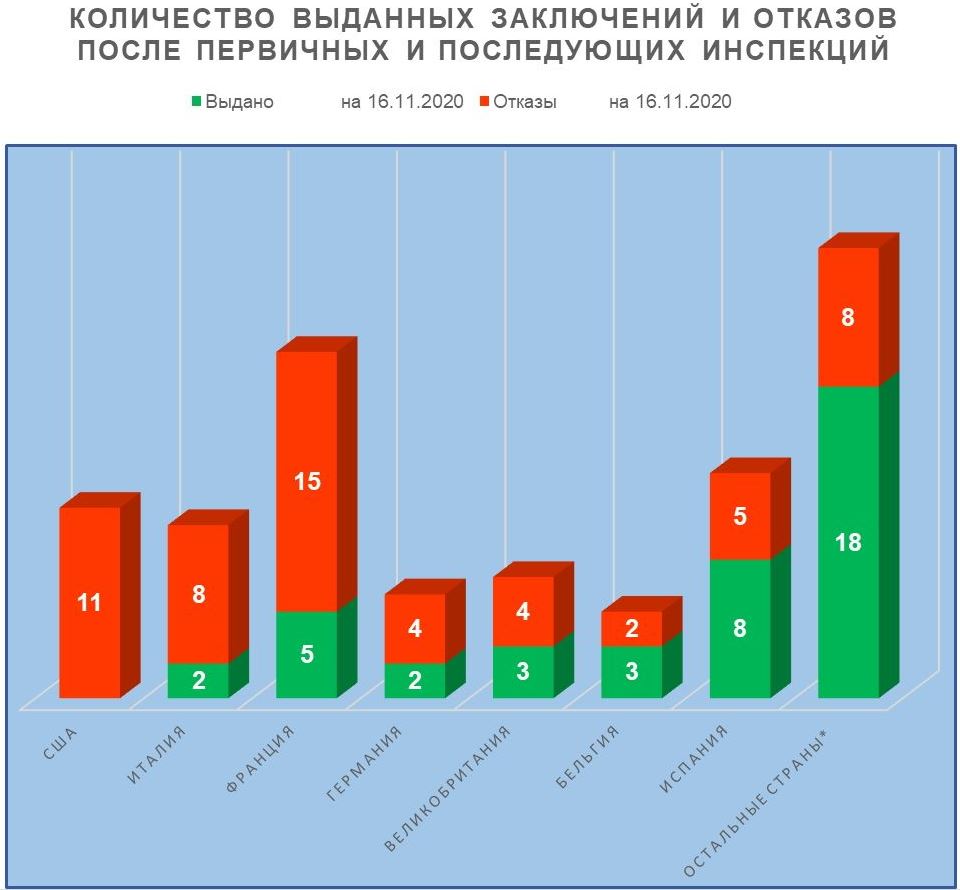
Однако необходимо отметить, что результаты некоторых инспекций, проведенных в 2020 году, могут стать известны только в 2021 году.
В 2020 году сотрудники Органа инспекции производства на соответствие требованиям надлежащей производственной практики ФГБУ «ВГНКИ» провели 14 инспекций иностранных производителей, в том числе 10 в дистанционном режиме [2].
Заявители
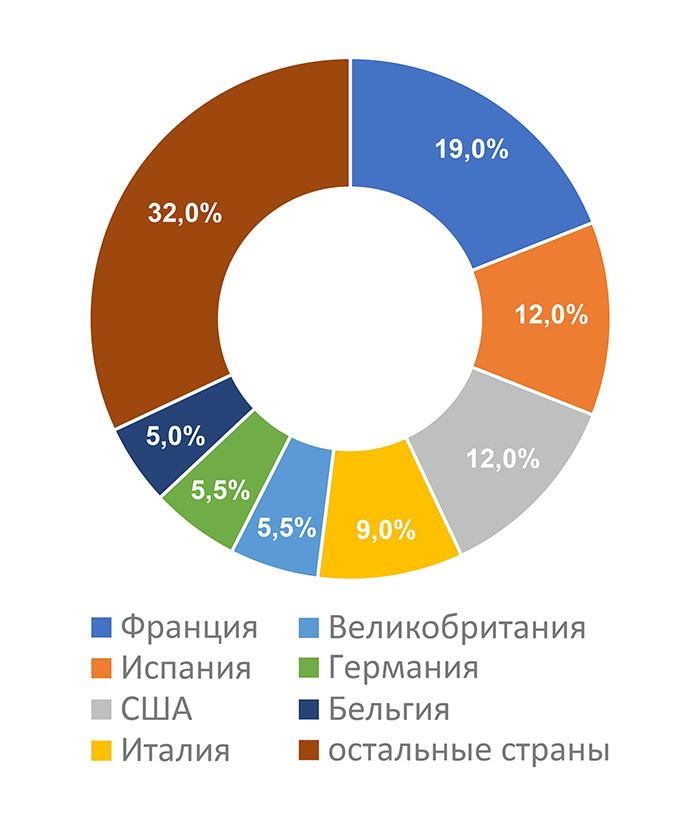
Совместив данные в реестре выдачи заключений с данными в графике проведения инспектирования, опубликованном на сайте Россельхознадзора 28.12.2020 г. [3], можно сделать вывод о том, что наибольшее число заявлений о выдаче заключения было представлено в Россельхознадзор для производственных площадок, расположенных во Франции, Испании, США, Италии, Великобритании, Германии и Бельгии.
Инспектирование в 2021 году
В соответствии с графиком проведения инспектирования, на 2021 год уже запланировано 39 инспекций производителей ветеринарных препаратов, площадки которых расположены в Беларуси, Бельгии, Болгарии, Бразилии, Великобритании, Венгрии, Вьетнаме, Германии, Испании, Италии, Китае, Новой Зеландии, Португалии, США, Уругвае, Финляндии, Франции и Чехии.
Последние изменения, связанные с инспектированием
В июне 2020 года на официальном интернет-портале правовой информации publication.pravo.gov.ru было опубликовано Постановление Правительства Российской Федерации от 29.05.2020 № 789 «О внесении изменения в Правила организации и проведения инспектирования производителей лекарственных средств на соответствие требованиям Правил GMP, а также выдачи заключений о соответствии производителя лекарственных средств указанным требованиям». В документе указано, что в условиях угрозы возникновения, возникновения и ликвидации чрезвычайной ситуации и (или) при возникновении угрозы распространения заболевания, представляющего опасность для окружающих, заболеваний и поражений, полученных в результате воздействия неблагоприятных химических, биологических, радиационных факторов, при которых проведение инспектирования производителя, предусматривающего осмотр производственной площадки, не представляется возможным, заключение выдается на срок 3 года, который исчисляется со дня окончания проведения инспектирования производственной площадки по документам, в том числе с использованием средств дистанционного взаимодействия, включая аудио- или видеосвязь [4].
Некоторые рекомендации по подготовке к дистанционному инспектированию производителей лекарственных средств на соответствие требованиям Правил GMP можно найти здесь: https://pharmprom.ru/podgotovka-k-distancionnomu-gmp-inspektirovaniyu/
В сентябре 2020 года на официальном интернет-портале правовой информации publication.pravo.gov.ru было опубликовано Постановление Правительства Российской Федерации от 05.09.2020 № 1361 «О внесении изменения в Правила организации и проведения инспектирования производителей лекарственных средств на соответствие требованиям Правил GMP, а также выдачи заключений о соответствии производителя лекарственных средств указанным требованиям». Теперь в случае, если при проведении инспектирования иностранного производителя были выявлены несоответствия требованиям Правил GMP, комиссией инспекторов в срок, не превышающий 25 рабочих дней со дня окончания инспектирования, составляется инспекционный отчет без заполнения раздела, содержащего заключительные рекомендации и выводы. Один из экземпляров такого отчета вместе с уведомлением, содержащим предложение об оплате дополнительных услуг по инспектированию, и счетом на оплату этих услуг направляется иностранному производителю или его уполномоченному представителю в течение 3 рабочих дней со дня подписания отчета. План корректирующих и предупреждающих действий (план САРА) оформляется производителем и содержит мероприятия по устранению выявленных несоответствий. Иностранный производитель или его уполномоченный представитель в срок не позднее 60 рабочих дней со дня получения им инспекционного отчета (без заполнения раздела, содержащего заключительные рекомендации и выводы) вправе представить в уполномоченное учреждение письмо с приложением плана CAPA и копий документов, оформленных в установленном порядке, содержащих мероприятия по его выполнению, а также документа, подтверждающего оплату дополнительных услуг по инспектированию. В этом случае, оплата этих услуг осуществляется в порядке, предусмотренном в соглашении между иностранным производителем и уполномоченным учреждением. Комиссия инспекторов в срок не позднее 25 рабочих дней со дня поступления в уполномоченное учреждение плана CAPA и копий документов, содержащих мероприятия по его выполнению, осуществляет их оценку, и подготавливает заключительную часть инспекционного отчета, содержащую заключительные рекомендации и выводы. Если же иностранный производитель не предоставляет в указанный срок план CAPA и копии документов, содержащих мероприятия по его выполнению, комиссия инспекторов в срок не позднее 3 рабочих дней̆ со дня окончания срока, установленного для представления плана CAPA и копий документов, содержащих мероприятия по его выполнению, подготавливает инспекционный̆ отчет. В течение 3 рабочих дней со дня подписания отчета один из его экземпляров направляется иностранному производителю или его уполномоченному представителю [5].
В октябре 2020 года Россельхознадзор сообщил, что с 1 января 2021 года вступают в силу Правила GMP Евразийского экономического союза, утвержденные Решением Совета ЕЭК от 03.11.2016 № 77, в отношении лекарственных средств для ветеринарного применения. Соответствие данным Правилам будет учитываться при выдаче производителям лекарственных средств для животных разрешений (лицензий) на указанную деятельность, а также при их инспектировании [6].
Помимо этого, в октябре на Федеральном портале проектов нормативных правовых актов regulation.gov.ru был размещен проект «О внесении изменений в Приказ Россельхознадзора от 18.10.2016 № 755 «Об утверждении формы заявления о выдаче заключения о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям Правил GMP, формы инспекционного отчета по результатам инспектирования производителя (иностранного производителя) лекарственных средств для ветеринарного применения на соответствие требованиям Правил GMP и формы заключения о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям Правил GMP. Основанием для разработки проекта приказа являются положения Правил GMP, касающиеся требований к производству ветеринарных лекарственных средств, утвержденные Решением Совета ЕЭК от 03.11.2016 № 77. В тексте проекта предусмотрено внесение изменений в форму инспекционного отчета и в форму заключения о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям Правил GMP [7].
О переходе производителей ветеринарных препаратов на Правила GMP ЕАЭС можно прочитать здесь: http://www.spzoo.ru/cntnt/default/n6439.html
В ноябре 2020 года в Государственную Думу Федерального Собрания Российской Федерации был внесен проект Федерального закона «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» в части ввода в гражданский оборот лекарственных препаратов для ветеринарного применения». В тексте проекта предусмотрено, что ввод в гражданский оборот ввозимого (перемещаемого) в Российскую Федерацию лекарственного препарата для ветеринарного применения осуществляется при наличии заключения о соответствии производителя лекарственных средств требованиям Правил GMP, выданного уполномоченным федеральным органом исполнительной власти для производственной площадки лекарственного препарата для ветеринарного применения, вводимого в гражданский оборот. Советом Государственной Думы было принято решение включить указанный проект Федерального закона в проект примерной программы законопроектной работы Государственной Думы в период весенней сессии 2021 года (январь) [8].
В декабре 2020 года на официальном интернет-портале правовой информации publication.pravo.gov.ru был опубликован Приказ Россельхознадзора от 07.10.2020 г. № 1078 «Об утверждении методики расчета предельного размера платы за оказание услуги по инспектированию производителей лекарственных средств для ветеринарного применения, производство которых осуществляется за пределами Российской Федерации, на соответствие требованиям Правил GMP в целях выдачи заключений о соответствии производителя лекарственных средств для ветеринарного применения требованиям Правил GMP и предельного размера платы за оказание указанной услуги». Утвержденным документом признается утратившим силу приказ Россельхознадзора от 25.11.2016 г. № 865. Согласно представленному расчету, предельный размер платы за оказание услуги по инспектированию теперь составляет 4 853 689,16 рублей (с учетом командировочных расходов и НДС 20%) [9].
Мероприятия, связанные с подготовкой к инспектированию
В этом году в России было проведено несколько различных мероприятий, которые могли бы быть полезными производителям для подготовки к инспектированию, в частности:
- семинары для специалистов предприятий-производителей лекарственных средств для ветеринарного применения, проводившиеся ФГБУ «ВГНКИ»;
- V Всероссийская GMP-конференция с международным участием, организованная Минпромторгом России совместно с Федеральным бюджетным учреждением «Государственный институт лекарственных средств и надлежащих практик» (ФБУ «ГИЛС и НП») [10];
- предконференционный день I Ежегодной конференции ISPE ЕАЭС, в котором приняли участие эксперты ФБУ «ГИЛС и НП» [11];
- корпоративные семинары для компаний, реализующих «политику открытых дверей», в рамках совместной программы содействия внедрению лучших образцов надлежащих практик в российской фармацевтической отрасли — проект «СОЛИДАРНАЯ ПРОГРАММА ОБУЧЕНИЯ», инициатором которого выступили компания «ФАРМСТРАТЕГИЯ» и ФБУ «ГИЛС и НП» [12].
Мероприятия в 2021 году
На 2021 год на базе ФГБУ «ВГНКИ» подготовлено более 100 обучающих мероприятий, в том числе, семинары по правилам организации производства и контроля качества лекарственных средств в соответствии с требованиями Правил GMP [13]. На 26-27 января запланирован вебинар «Переход на Правила GMP ЕАЭС». Кроме того, на первую половину года уже запланированы вебинары по следующим темам:
- Производство, контроль качества, маркировка нестерильных лекарственных средств для ветеринарного применения;
- Управление претензиями и отзывами на предприятии;
- Стабильность и сроки годности лекарственных препаратов;
- Валидация микробиологических методик контроля;
- Фармацевтическая система качества;
- Воздухоподготовка. HVAC. Квалификация чистых помещений. Водоподготовка. PW/WFI. Квалификация. Валидация системы водоподготовки;
- Управление отклонениями и изменениями на предприятии. Анализ типичных несоответствий;
- Организация проведения работ по квалификации и валидации на предприятиях по производству лекарственных средств для ветеринарного применения;
- Организация складского хранения сырья, материалов и продукции;
- Организация проведения самоинспекции на фармацевтическом предприятии;
- Управление поставщиками материалов и услуг. Основные положения и ведение документации;
- Требования к помещениям, оборудованию, документации, контролю качества и складированию при производстве растительных препаратов;
- Валидация аналитических методик тестирования;
- Производство, система обеспечения качества иммунобиологических лекарственных средств для ветеринарного применения;
- GMP и деятельность инженерной службы предприятия.
В новом году первый вебинар проекта «СОЛИДАРНАЯ ПРОГРАММА ОБУЧЕНИЯ» пройдет 15 января [14]. На перовое полугодие намечено проведение 22 вебинаров (программа будет реализована в полном объеме в случае, если на каждый вебинар будет определена компания-Заказчик).
Производителям ветеринарных препаратов рекомендуется принимать участие в обучающих мероприятиях и тщательнее готовиться к GMP-инспектированию.
Представленный материал подготовлен с использованием данных, актуальных на 30.12.2020. В случае получения новых или дополнительных данных, статья может быть обновлена.
Материал опубликован на портале spzoo.ru
- Россельхознадзор / Регистрация и лицензирование / Инспектирование. Выдача заключения / Реестр заключений о соответствии производителя требованиям правил надлежащей производственной практики. URL: https://fsvps.ru/fsvps/regLicensing/conclusion/conclusionReestr.html (дата обращения 30.12.2020)
- ФГБУ «ВГНКИ» / Пресс-центр / Новости / Результаты работы подведомственного Россельхознадзору ФГБУ «ВГНКИ» за 2020 год. URL: http://www.vgnki.ru/rezultaty-raboty-podvedomstvennogo-rosselhoznadzoru-fgbu-vgnki-za-2020-god.html (дата обращения 30.12.2020)
- Россельхознадзор / Регистрация и лицензирование / Инспектирование. Выдача заключения / Информация для заявителя / График проведения инспектирования (обновлено 28.12.2020). URL: https://fsvps.gov.ru/fsvps-docs/ru/regLicensing/docs/conclusionSchedule28122020.pdf (дата обращения 30.12.2020)
- Официальный интернет-портал правовой информации / Постановление Правительства Российской Федерации от 29.05.2020 № 789 «О внесении изменения в Правила организации и проведения инспектирования производителей лекарственных средств на соответствие требованиям правил надлежащей производственной практики, а также выдачи заключений о соответствии производителя лекарственных средств указанным требованиям». URL: http://publication.pravo.gov.ru/Document/View/0001202006020025?rangeSize=1 (дата обращения 30.12.2020)
- Официальный интернет-портал правовой информации / Постановление Правительства Российской Федерации от 05.09.2020 № 1361 «О внесении изменений в Правила организации и проведения инспектирования производителей лекарственных средств на соответствие требованиям правил надлежащей производственной практики, а также выдачи заключений о соответствии производителя лекарственных средств указанным требованиям». URL: http://www.publication.pravo.gov.ru/Document/View/0001202009090005 (дата обращения 30.12.2020)
- Россельхознадзор / Новости / С 2021 года изменятся требования к соискателям и лицензиатам, осуществляющим деятельность по производству лекарственных средств для ветеринарного применения. URL: https://fsvps.gov.ru/fsvps/news/38067.html (дата обращения 30.12.2020)
- Федеральный портал проектов нормативных правовых актов / О внесении изменений в приказ Россельхознадзора от 18.10.2016 № 755 «Об утверждении формы заявления о выдаче заключения о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики, формы инспекционного отчета по результатам инспектирования производителя (иностранного производителя) лекарственных средств для ветеринарного применения на соответствие требованиям правил надлежащей производственной практики и формы заключения о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики». URL: https://regulation.gov.ru/projects#npa=109167 (дата обращения 30.12.2020)
- СОЗД ГАС «Законотворчество» / Главная / Объекты законотворчества / Законопроект №1057597-7 / О внесении изменений в Федеральный закон «Об обращении лекарственных средств» в части ввода в гражданский оборот лекарственных препаратов для ветеринарного применения URL: https://sozd.duma.gov.ru/bill/1057597-7 (дата обращения 30.12.2020)
- Федеральный портал проектов нормативных правовых актов / Приказ Федеральной службы по ветеринарному и фитосанитарному надзору от 07.10.2020 № 1078 «Об утверждении методики расчета предельного размера платы за оказание услуги по инспектированию производителей лекарственных средств для ветеринарного применения, производство которых осуществляется за пределами Российской Федерации, на соответствие требованиям правил надлежащей производственной практики в целях выдачи заключений о соответствии производителя лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики и предельного размера платы за оказание указанной услуги» (Зарегистрирован 16.12.2020 № 61505). URL: http://publication.pravo.gov.ru/Document/View/0001202012170014 (дата обращения 30.12.2020)
- V Всероссийская GMP-конференция с международным участием. URL: http://gosgmp.ru/ (дата обращения 30.12.2020)
- ФБУ «ГИЛС и НП» / Новости / 2020 / Эксперты ФБУ «ГИЛС и НП» Минпромторга России приняли участие в предконференции Евразийского отделения ISPE. URL: https://gilsinp.ru/?news=eksperty-fbu-gils-i-np-minpromtorga-rossii-prinyali-uchastie-v-predkonferentsii-evrazijskogo-otdeleniya-ispe (дата обращения 30.12.2020)
- Совместная программа содействия внедрению лучших образцов надлежащих практик в российской фармацевтической отрасли / Отчеты / Фармотрасль активно поддерживает «Солидарную программу обучения». URL: https://www.goodpractices.ru/upload/iblock/a82/post_reliz_Solidarnaya-programma-obucheniya.-Itogi-2020.pdf (дата обращения 30.12.2020)
- ФГБУ «ВГНКИ» / Образование / Дополнительное профессиональное образование / Планы мероприятий / План обучающих мероприятий для специалистов предприятий-производителей лекарственных средств для ветеринарного применения на 2021 год. URL: http://www.vgnki.ru/assets/files/plan-2021-itog_proizvoditeli.pdf (дата обращения 30.12.2020)
- Совместная программа содействия внедрению лучших образцов надлежащих практик в российской фармацевтической отрасли / Отчеты / Календарно-тематический план «Солидарной программы обучения» (январь-июнь 2021 г.). URL: https://www.goodpractices.ru/upload/iblock/ca6/SP-i-SOR_2021.pdf (дата обращения 30.12.2020)


