
Лекарственное средство – это сложный продукт, изготовленный в специальных условиях и в соответствии со строгими правилами производства. Чтобы сохранить его эффективность, всем субъектам обращения необходимо обеспечить соблюдение правил хранения и транспортирования, при нарушении которых терапевтический эффект может быть искажен.
Одним из основных факторов является температурный режим, непосредственно влияющий на качество препаратов. Обеспечение оптимальных условий согласно требованиям производителей – достаточно трудная задача, так как кратковременные отклонения повсеместно встречаются при прохождении лекарственных средств по цепям поставок.

В данной статье рассматривается практический опыт работы с обозначенной проблемой.
Допустимые отклонения температуры, определяемые производителем
При планировании и проведении исследований стабильности лекарств и фармацевтических субстанций предусмотрена оценка влияния кратковременных отклонений на пределы заявленных условий хранения (возможных при транспортировке)[1]. Эти исследования обычно содержатся в отчете, который входит в регистрационное досье на препарат для медицинского применения и предоставляется по запросу уполномоченного органа.

Для дистрибьютора размещенная в досье информация недоступна, но данные об исследованном кратковременном отклонении температуры можно найти в других источниках. В соответствии с правилами хранения и перевозки препаратов[2] они указываются в инструкции по медицинскому применению, на упаковке самого лекарства или транспортной тары.
Пример – «ЭпиВакКорона» (рис.1), зарегистрированная в Государственном реестре лекарственных средств под номером ЛП-006504[3]. На коробке написано, что препарат хранится при температуре от 2 до 8 ℃. В инструкции по применению, которую можно найти в потребительской упаковке, или в госреестре эта информация расширена. Там сказано, что «допускается кратковременное (не более 48 часов) транспортирование при температуре не выше 25 ℃».

К сожалению, условия транспортирования в инструкции по применению указываются редко. При этом они не охватывают весь спектр встречающихся кратковременных отклонений.
Можно еще упомянуть, что многие до сих пор пользуются старым 14-м изданием Государственной фармакопеи РФ, где в ОФС «Хранение лекарственных средств»[4] было установлено требование: «При хранении лекарственных средств, требующих защиты от влияния факторов внешней среды (света, температуры, атмосферного состава воздуха и др.), необходимо обеспечить указанный в фармакопейной статье или нормативной документации режим хранения. Отклонения от регламентируемых условий допускаются однократно только на краткосрочный период (не более 24 ч), если при этом специальные условия, например, постоянное хранение в холодном месте, не оговорены отдельно».
В новой редакции ОФС «Хранение лекарственных средств»[5] этого требования нет.
Предлагаемые методы обоснования кратковременных отклонений
В последнее время фармацевтический рынок прилагает ряд усилий по выработке методов обоснования кратковременных отклонений. Особенно в этом заинтересованы транспортные компании, и для этого есть ряд причин.
Во-первых, перевозка препаратов – основной источник риска кратковременных отклонений. Во-вторых, ужесточение требований к соблюдению температурного режима происходит в момент передачи ответственности за груз. В настоящее время Фармакопейным комитетом ЕЭК обсуждается проект ОФС «Оценка температурных колебаний при хранении и транспортировке лекарственных препаратов».
Также в сообществе «SCM Pharm: логистика лекарственных средств» проходит онлайн-обсуждение проекта ОФС «Хранение и транспортирование лекарственных средств»[6], где затрагиваются вопросы кратковременных отклонений. Как вариант, предлагается использовать среднюю кинетическую температуру, однако ряд авторов указывает на несостоятельность этого метода[7] по следующим причинам:
- расчет средней кинетической температуры – это упрощенный способ выражения общего влияния колебаний. Большой ряд условностей в лучшем случае усложняет алгоритм, а в худшем – делает его непригодным для применения;
- формула рассматривает только кинетическую (поступательную) энергию молекул, другие виды (электронная, колебательная, вращательная) в расчет не берутся;
- она применима только к простейшим реакциям, а современные лекарственные средства – это сложные по составу и природе вещества;
- энергия активации Ea – эмпирическая величина, которая определяется опытным путем и требует специальных знаний, навыков и оборудования для ее определения;
- средняя кинетическая температура может быть использована только с учетом предыдущих кратковременных отклонений;
- Нобелевский лауреат по химии Вильгельм Оствальд говорил: «Температурная зависимость скоростей химических реакций – одно из самых темных мест в химической механике». Доверять качество фармацевтической субстанции «темным местам», думаю, недопустимо.
Второй предлагаемый метод – это проведение температурного картирования, который, по мнению разработчиков ОФС, поможет обосновывать кратковременные отклонения. При этом не расписана методика подобной оценки.
Как считают авторы, основной недостаток предлагаемых способов состоит в том, что в данных ОФС предпринимается попытка сделать вывод о качестве медикамента в других субъектах обращения, что нарушает требования Федерального закона от 12.04.2010 N 61-ФЗ – за качество, эффективность и безопасность препарата отвечает держатель или владелец регистрационного удостоверения (разработчик, производитель или иное юридическое лицо).
Валидация процессов, в которых есть риск отклонений температуры
Начнем рассмотрение этого вопроса с ОФС.1.1.0028 «Контроль температуры и влажности с течением времени»[8], которая была впервые введена в 15 издание Государственной фармакопеи РФ. Она гласит, что «наблюдаемая температура окружающей среды не всегда является надежным показателем действительной температуры различных объектов».
При кратковременных отклонениях температура воздуха может не совпадать с температурой грузовой единицы, которую переместили, например, из холодильной камеры в помещение с комнатной температурой для последующей загрузки в рефрижератор. Должно пройти какое-то время, чтобы грузовая единица приняла температуру окружающей среды, передала свое тепло заводской упаковке, потребительской, первичной и «добралась» до активного вещества. И только температура самого активного вещества может повлиять на стабильность и снизить фармакологический эффект данного препарата (рис. 2).
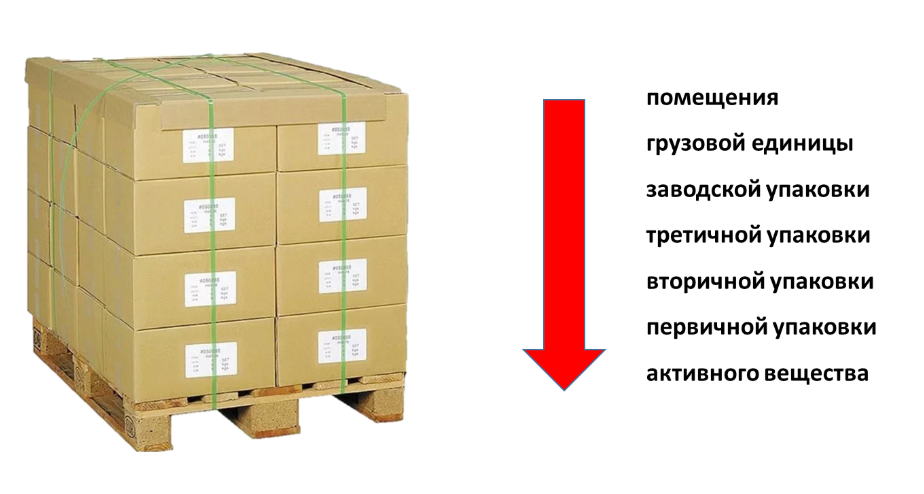
Логично предположить, что мы имеем некоторое время, в течение которого температура препаратов остается в пределах установленных производителем диапазонов, несмотря на повышение градуса в помещении. На этом предположении и основаны испытания, проводимые при валидации процессов, и в них есть риск кратковременных отклонений.
Каждый процесс, в данном случае погрузка/разгрузка, характеризуется основными показателями, например:
- устройство площадок,
- организация работ,
- численность технических средств,
- количество задействованного персонала,
- квалификация персонала,
- варианты использования оборудования, способа хранения,
- варианты загрузки транспорта и так далее.
Эти характеристики формируют время, затраченное на загрузку/разгрузку транспорта. Сравнивая его с временем, необходимым для сохранения температура внутри грузовой единицы в рамках установленных пределов, мы вправе сделать вывод о выполнении заданных требований (температура внутри грузовой единицы остается в норме). Так, согласно СОП, будут постоянно достигаться результаты, заранее соответствующие установленным критериям приемлемости, то есть без температурных нарушений.
Каждой организации нужно определить ключевые процессы, которые подлежат валидации. Это любое решение, влияющее на показатели качества лекарственного средства либо его стабильность. Объем работ определяется на основе документально оформленного анализа рисков. Процедура дополняется отчетами, в которых должны быть обобщены полученные результаты, а также даны объяснения выявленным отклонениям[9].
На что нужно обращать внимание
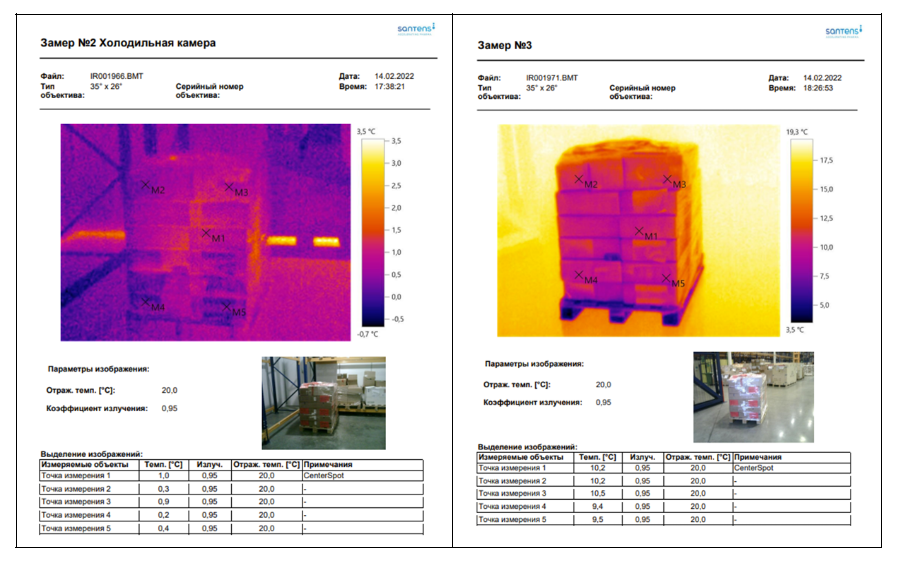
При валидации процесса погрузки/разгрузки медикаментов на складе компании «САНТЕНС СЕРВИС» (Терминал «Лешково 2») мы столкнулись с ошибкой в определении «безопасного» времени нахождения палеты с лекарственными препаратами. План испытания при этом заключался в следующем: грузовую (транспортную) единицу выдерживали в ходильной камере до установления теплового равновесия, затем перемещали ее в помещение с комнатной температурой и измеряли скорость изменения градуса тепловизором Testo 883 со стандартным объективом (рис. 3).
Тепловизором также измеряли время выхода температуры палеты с лекарствами за пределы установленных критериев приемлемости. На это на протяжении большого количества испытаний уходила неполная минута, что значительно меньше времени, предусмотренного СОП.
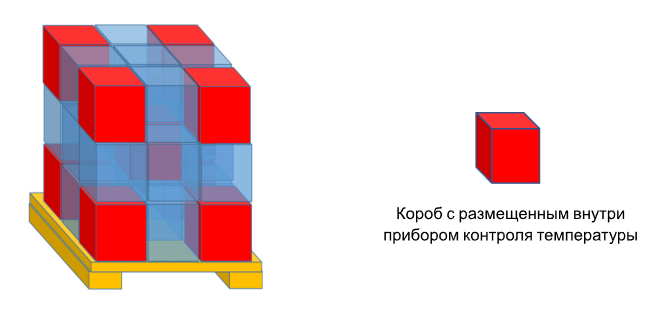
В данном случае с помощью тепловизора мы регистрировали температуру поверхности грузовой единицы, но больший интерес представляла температура внутри первичной упаковки. Для второго этапа испытаний мы подготовили грузовую единицу из пустых коробов и поместили в нее приборы контроля (рис. 4), которые фиксировали показатели с интервалом в 1 минуту.
Здесь важно отметить, что погрузку/разгрузку мы проводили для склада дистрибьютора, оперирующего большой номенклатурой лекарственных средств. Поэтому использовали пустые короба, имитируя тем самым наихудший случай. Любой помещенный в них предмет в данном случае усилит теплоемкость грузовой единицы и тем самым увеличит время ее нагрева до верхней границы допустимого диапазона.
Полученное время мы сравнили со временем проведения процесса и убедились, что температура внутри грузовой единицы не выходит за установленные пределы. Так достигаются результаты, соответствующие критериям приемлемости, то есть без нарушения температуры хранения препарата.
Выводы
Кратковременные отклонения температуры хранения и транспортировки от установленной производителем встречаются довольно. Отклонения могут повлиять на качество лекарственных средств. При определенных обстоятельствах они могут стать причиной обращения регуляторных органов в суд с заявлением об аннулировании лицензии на фармацевтическую деятельность.
Ответственность за качество, эффективность и безопасность медикамента – прерогатива держателя или владельца регистрационного удостоверения (разработчика, производителя или иного юридического лица). Замена на другие субъекты обращения лекарственных средств невозможна.
Применение средней кинетической температуры (mean kinetic temperature, МКТ) при оправдании кратковременных отклонений затруднено, использование картирования сомнительно (скорее, невозможно). Для решения проблемы организация должна определить ключевые процессы, которые способны повлиять на показатели качества препарата либо изменить информацию о стабильности и провести валидацию.
Ссылки
- Решение Коллегии Евразийской экономической комиссии от 10 мая 2018 г. N 69 «Об утверждении Требований к исследованию стабильности лекарственных препаратов и фармацевтических субстанций».
- Приказ Минздрава РФ от 31 августа 2016 г. N 646н «Об утверждении Правил надлежащей практики хранения и перевозки лекарственных препаратов для медицинского применения».
- Государственный реестр лекарственных средств (minzdrav.gov.ru).
- Хранение лекарственных средств ОФС.1.1.0010.18.
- Хранение лекарственных средств ОФС.1.1.0010.15.
- SCM Pharm. Онлайн-обсуждение проекта ОФС «Хранение и транспортирование лекарственных средств».
- Сборник практических статей GDP REVIEW 1.
- Контроль температуры и влажности с течением времени ОФС.1.1.0028.
- Совет ЕЭК, решение от 3 ноября 2016 года N 80 «Об утверждении Правил надлежащей дистрибьюторской практики в рамках Евразийского экономического союза».
Источник – Сборник GDP Review 5 VI Конференции «Логистика лекарственных средств»


