К концу 2025 года правила производства и регистрации лекарственных препаратов и медицинских изделий на территории ЕАЭС должны быть полностью унифицированы. За счет этого снизятся административные издержки для производителей, а пациенты получат доступ к современным, безопасным, качественным и эффективным лекарствам и медицинским изделиям, об этом говорится в отчете за 2020 год, опубликованном Евразийской экономической комиссией.
Переход к общим рынкам лекарственных средств и медицинских изделий осуществляется поэтапно, это помогает предпринимателям лучше адаптироваться к новым условиям.
Рынок лекарственных средств в рамках реализации Соглашения
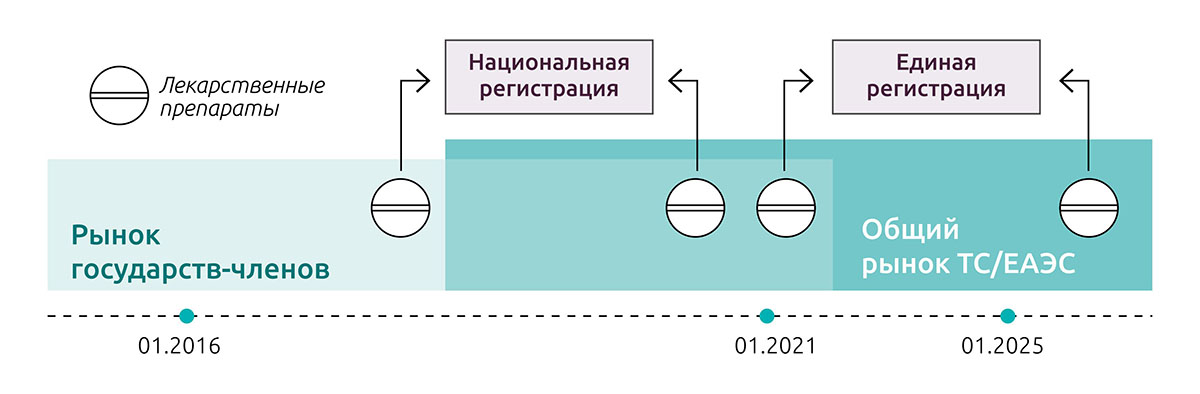 В документе подчеркивается, что в сфере обращения лекарственных средств заявитель имел право выбрать для регистрации лекарств национальные или общесоюзные правила до 31 декабря 2020 года (см. информацию по переходному периоду). При этом досье препаратов, которые зарегистрированы в соответствии с национальными нормами, до 31 декабря 2025 года должны быть приведены в соответствие с нормами ЕАЭС. В сфере обращения медицинских изделий переходный период завершится 31 декабря 2021 года, далее регистрация медицинских изделий будет осуществляться только по правилам Союза.
В документе подчеркивается, что в сфере обращения лекарственных средств заявитель имел право выбрать для регистрации лекарств национальные или общесоюзные правила до 31 декабря 2020 года (см. информацию по переходному периоду). При этом досье препаратов, которые зарегистрированы в соответствии с национальными нормами, до 31 декабря 2025 года должны быть приведены в соответствие с нормами ЕАЭС. В сфере обращения медицинских изделий переходный период завершится 31 декабря 2021 года, далее регистрация медицинских изделий будет осуществляться только по правилам Союза.
В 2020 году была продолжена работа по подготовке проектов руководств и требований по узкоспециальным вопросам обращения лекарственных средств, обеспечивающих единые в рамках ЕАЭС подходы в сфере производства и исследования лекарственных препаратов. Наиболее значимым документом, принятым в 2020 году, является первая часть первого тома Фармакопеи ЕАЭС, в которую вошли общие фармакопейные статьи, содержащие общие сведения о применении фармакопейного анализа и его методиках, методах биологических и микробиологических испытаний, реактивах, приборах аппаратах для анализа качества как уже обращающихся на рынке, так и новых, еще только разрабатываемых лекарств. Фармакопея станет основой единого подхода к оценке качества лекарственных средств в ЕАЭС. Документ начнет действовать с 1 марта 2021 года. Производителям лекарственных препаратов, ранее зарегистрированных на общем рынке ЕАЭС, предоставлен 5-летний переходный период — до 1 января 2026 года — для приведения своих нормативных документов по качеству лекарственных средств в соответствие с Фармакопеей ЕАЭС.
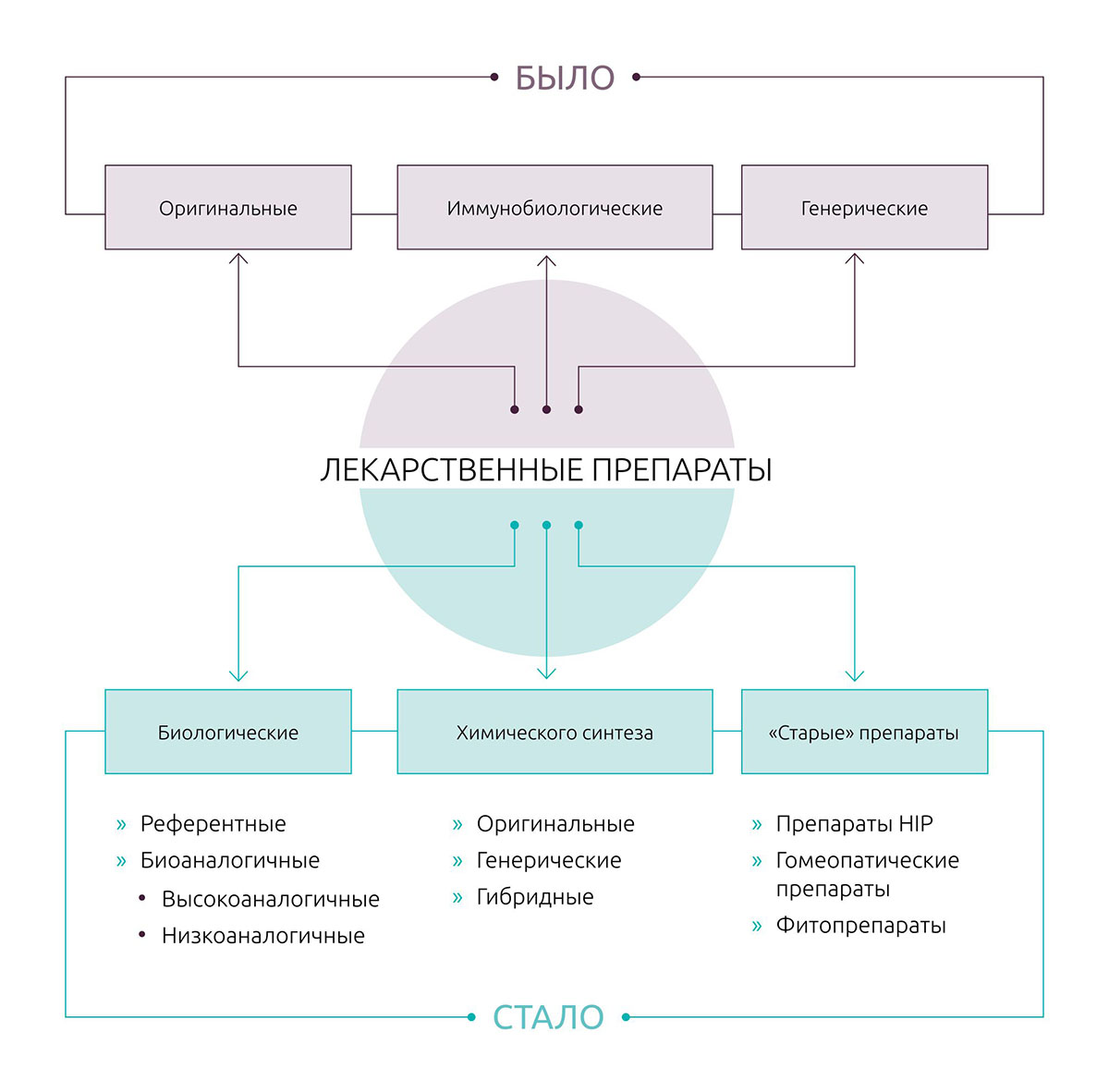
Изменение регуляторной классификации препаратов
 В целом, нормативная база по общим рынкам полностью сформирована. Она включает в себя систему из 47 нормативных актов в сфере обращения лекарственных средств и 28 документов в сфере обращения медицинских изделий.
В целом, нормативная база по общим рынкам полностью сформирована. Она включает в себя систему из 47 нормативных актов в сфере обращения лекарственных средств и 28 документов в сфере обращения медицинских изделий.
Также в документе представлены первые результаты единого рынка, данные приводятся по состоянию на декабрь 2020 года:
- подано 575 заявлений по единым правилам регистрации лекарственных препаратов ЕАЭС, 92 регистрационных удостоверения выдано, информация внесена в единый реестр;
- подано более 50 заявлений на регистрацию медицинских изделий по единым правилам ЕАЭС, выдано 4 регистрационных удостоверения;
- подано 212 заявлений на фармацевтические инспекции и завершено более 40 фармацевтических инспекций производителей лекарственных средств, по результатам которых выдано 35 сертификатов GMP ЕАЭС.


