Внедрение информационной системы мониторинга движения лекарственных препаратов (ИС МДЛП) — самый обсуждаемый и, определенно, один из самых сложных проектов 2020 года, который затронул все сегменты фармацевтической отрасли. Маркировка лекарственных препаратов заставила адаптироваться всех производителей, дистрибьюторов и аптеки. В рамках этого проекта одной из самых важных задач было налаживание коммуникации между отделами на производстве и контрагентами для быстрого достижения желаемого результата.
 |
 |
Затронем схему взаимодействия не только внутри фармацевтического производства, но и за его пределами, а именно дистрибьюторов и центра развития перспективных технологий «Честный ЗНАК».
С чего начать? Каковы первые шаги и в каком направлении начать двигаться?
Если у вас как производителя при внедрении проекта возник такой вопрос, значит, налицо проблемы с коммуникацией между отделами, поставщиками оборудования и программного обеспечения, дистрибьюторами, а также центром развития перспективных технологий «Честный ЗНАК», которые являются представителями этой информационной структуры. Ответ на этот вопрос есть, потому предлагаем выстроить эффективную модель взаимодействия, которая выглядит следующим образом: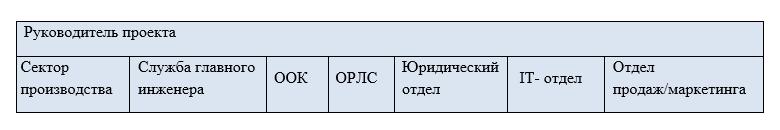 Модель взаимодействия подразумевает назначение лидера, инициатора проекта и группу специалистов – профессионалов в своих направлениях. Все специалисты делают одно общее дело и нацелены на результат, а результат – это выпуск качественной готовой продукции.
Модель взаимодействия подразумевает назначение лидера, инициатора проекта и группу специалистов – профессионалов в своих направлениях. Все специалисты делают одно общее дело и нацелены на результат, а результат – это выпуск качественной готовой продукции.
Руководителем проекта назначается проектный менеджер, но если предприятие некрупное, то директор по производству (начальник производства) вполне может справиться самостоятельно. Его задача самая важная, так как он – связующее звено между отделами на этапе внедрения. Руководитель проекта определяет состав рабочей группы. Каждый отдел представляет свой непосредственный руководитель.
Первоначально нужно зарегистрироваться в ИС МДЛП, используя усиленную квалифицированную электронную подпись. После регистрации в системе рабочей группой должны быть расставлены приоритеты для отдела регистрации лекарственных средств (ОРЛС). Этот отдел совместно с IT-специалистами или сектором производства должен создать реестр лекарственных препаратов в ИС МДЛП, используя информацию из GS1 (международная организация, ведающая вопросами стандартизации учета и штрихового кодирования логистических единиц). Остальные отделы параллельно составляют максимально подробное URS (User Requirements Specification – требования пользователя), особое внимание уделив программному обеспечению и составу оборудования, проводят анализ рисков.
Поставщиков оборудования очень много. Они непременно будут «сладко» рассказывать о том, что именно их готовое решение способно удовлетворить все ваши требования, что брака 0%, наносить код Data Matrix можно будет где угодно, и он гарантированно будет верифицироваться. На этом этапе руководитель проекта проводит подбор поставщика согласно URS. Новое оборудование, скорее всего, вы будете внедрять взамен старого, потому важно согласовать с поставщиком на этапе технического задания все габариты станции сериализации и агрегации, место установки и все нюансы с нанесением Data Matrix. Стоит также определить, каким образом вы будете наносить коды (термотрансферная, каплеструйная, сольвентная, лазерная печать) и выбрать оборудование для эффективной агрегации.
Рассматривая трех-четырех поставщиков оборудования, обязательно вызовите инженеров от поставщика для обследования производственных линий и обсуждения URS. Остановитесь на выборе поставщика, который максимально вписывается в ваши критерии приемлемости.
Согласуйте совместно с юридическим отделом договор поставщика, пропишите в нем все ваши требования, также обязательно согласуйте FAT/SAT-протоколы тестирования с поставщиком, объясните юристам, для чего это нужно. Ведь по результатам этих тестов вы будете осуществлять приемку оборудования и программного обеспечения! FAT/SAT-протоколы помогут в дальнейшем в квалификации оборудования, ускорят процесс валидации. Сроки поставки обычно составляют шесть месяцев, это стандартная практика, так что распланируйте это заранее.
Пара слов о фармацевтической системе качества
Перед сектором производства и отделом обеспечения качества стоит обязательное требование квалифицировать новое оборудование и валидировать компьютеризированные системы, вносить изменения в промышленные регламенты (рецептуры), технологические инструкции, актуализировать SOP (Standard Operating Procedure). Зная сроки поставки, отдел обеспечения качества сможет распланировать свою работу и подготовить необходимую документацию и тесты заранее. Как только оборудование будет готово на площадке поставщика, проведите FAT-тестирование (Factory Acceptance Test). В случае несоответствий с указанными тестами протокола примите решение об исправлении этих недочетов. Повторите испытания, и если они пройдут успешно, оборудование можно будет отправлять на производственную площадку. FA- испытания помогут ООК при IQ (этап квалификации монтажа) и OQ (этап квалификации функционирования). При приемке на производстве проведите SAT-испытания (On Site Acceptance Test) – испытания оборудования после доставки на вашу производственную площадку. При SAT-испытаниях проверяются, как правило, системы, которые могли пострадать при транспортировке и сборке/разборке оборудования.
Нужна ли автоматизация бизнес-процессов?
И вот оборудование квалифицировано, сектор производства обучил персонал, предприятие готово к выпуску лекарственных препаратов, но тут вы столкнетесь с проблемой коммуникации и контроля выполнения обязательных операций в ИС МДЛП между отделами предприятия, участвующими в выпуске ЛП. Для этого крупному предприятию необходима ERP-система (Enterprise Resource Planning), то есть программное обеспечение для управления бизнес-процессами. Если вы не можете себе позволить реализацию ERP-системы, то предлагаем реализовать это через систему Bitrix24. Автоматизация бизнес-процессов на предприятии улучшит взаимодействие между отделами при планировании производства, постановке задач на отбор проб инженеру отдела контроля качества, контроле проведения испытаний, получении сведений о вводе в гражданский оборот в АИС Росздравнадзора от уполномоченного лица, введении в оборот специалистом по маркировке в ИС МДЛП. Каждый ключевой сотрудник будет знать, что нужно делать в данный момент для успешного выпуска ЛП. При помощи ERP вы сможете контролировать все бизнес-процессы, выявлять ошибки и вести учет.
Как взаимодействовать с дистрибьюторами?
Работа с дистрибьюторами может быть выстроена через прямое или обратное акцептование. При прямом акцепте отправителем регистрируются сведения об отгрузке покупателю препаратов, а получателем осуществляется подтверждение в ИС МДЛП зарегистрированных отправителем сведений об отгрузке. При обратном порядке акцептования в ИС МДЛП получателем регистрируются сведения о приемке медикаментов на склад, а отправителем осуществляется подтверждение сведений о приемке на склад покупателя.
При любом из акцептов будут возникать сбои или ошибки системы. От дистрибьюторов будут приходить рекламации
Работайте с поступающими от дистрибьюторов рекламациями по схеме: Любую проблему, связанную с маркировкой ЛП можно решить в кратчайшие сроки, главное, чтобы она вовремя была донесена до ключевых специалистов. Отдел продаж напрямую взаимодействует с дистрибьюторами и передает информацию о возникшей проблеме в отдел обеспечения качества. ООК должны зарегистрировать рекламацию и составить план CAPA (процедура корректирующих и предупреждающих действий) с выставлением сроков исполнения, выявления отклонения, анализа рисков, определения ответственного исполнителя. Информацию о ликвидации отклонения нужно донести до дистрибьютора в обратной последовательности. И закрыть CAPA.
Любую проблему, связанную с маркировкой ЛП можно решить в кратчайшие сроки, главное, чтобы она вовремя была донесена до ключевых специалистов. Отдел продаж напрямую взаимодействует с дистрибьюторами и передает информацию о возникшей проблеме в отдел обеспечения качества. ООК должны зарегистрировать рекламацию и составить план CAPA (процедура корректирующих и предупреждающих действий) с выставлением сроков исполнения, выявления отклонения, анализа рисков, определения ответственного исполнителя. Информацию о ликвидации отклонения нужно донести до дистрибьютора в обратной последовательности. И закрыть CAPA.
Сбои или ошибки ИС МДЛП вводят вас в безвыходные ситуации?
Напомним, что выход всегда есть. Постоянно взаимодействуйте с технической поддержкой центра развития перспективных технологий «Честный ЗНАК». Описывайте все ваши проблемы и отправляйте заявки по адресу support@crpt.ru, сохраняйте решения и накапливайте опыт, так как все ошибки типичны и могут повторяться. Участие в конференциях или вебинарах от ЦРПТ дает возможность осветить волнующие вас проблемы и получить ответ в режиме онлайн.
Подведем итоги
В заключении хочется кратко напомнить об основных мыслях данной статьи. Начиная работу по внедрению проекта, нужно выбрать руководителя проекта, обозначить первые шаги, создать реестр лекарственных препаратов в ИС МДЛП и URS-требования пользователя, уделяя большое внимание оборудованию и программному обеспечению. Далее – провести квалификацию оборудования и валидацию, обучить персонал. Чтобы контролировать работу и эффективность взаимодействия всех отделов, нужно автоматизировать все бизнес-процессы при помощи различных ERP-систем, выбирать подходящий вариант акцепта с дистрибьюторами, оперативно отвечать на рекламации. Активная работа с технической поддержкой ЦРПТ, участие в конференциях и вебинарах – все это увеличит шансы на решение возникающих проблем.
Безусловно, данная статья – не панацея для каждого фармацевтического предприятия, но она может стать помощником, алгоритмом действий для тех, кто испытывает трудности при внедрении проекта маркировки лекарственных препаратов или подобных систем.
Источник: GDP REVIEW 2 — Сборник практических статей III Международной конференции Логистика лекарственных средств 


