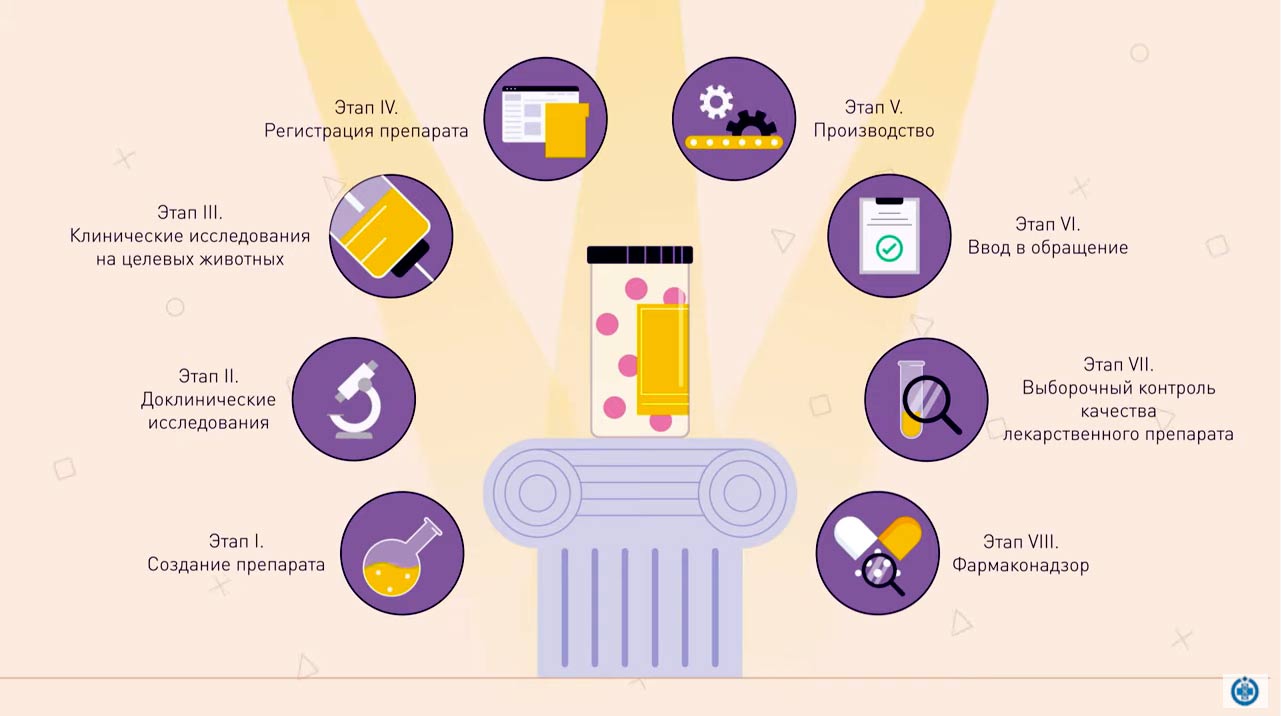
Эксперты Центра качества и стандартизации лекарственных средств для животных и кормов (ФГБУ «ВГНКИ») подготовили видеоматериал о жизненном цикле лекарственного препарата для ветеринарного применения. Каждый ветпрепарат проходит свой жизненный цикл, который состоит из нескольких этапов.
Первый этап – создание препарата
Первоначально исследователи выявляют действующие вещества (активные молекулы) с нужными свойствами и оценивают их токсические свойства. Если доза вещества для достижения требуемого эффекта ниже дозы, вызывающей токсические эффекты, молекула переходит на следующий этап изучения.
В процессе разработки нового ветеринарного препарата проводятся фармацевтические исследования, а именно: оценка физических и химических свойств препарата, изучение стабильности фармсубстанций, взаимодействия с другими веществами, выбирают вещества, которые смогут пролонгировать и стабилизировать действие препарата. Принимается решение по лекарственной форме выпуска изобретенного препарата.
Второй этап – доклинические испытания
Правила проведения доклинических исследований лекарственного препарата для ветеринарного применения регламентируются приказом № 101 Министерства сельского хозяйства РФ.
На этом этапе проводятся фармацевтические, токсикологические, исследования фармакодинамики и фармакокинетики, а также другие виды исследований. Препарат оценивают по широкому спектру показателей. На основании полученных данных по каждому виду исследований составляется общий отчет о результатах доклинических исследований.
Третий этап – клинические исследования на целевых животных
Согласно 101 приказу Министерства сельского хозяйства следующим этапом являются клинические исследования на целевых животных. На этом этапе разработчик должен уведомить Россельхознадзор о дате начала и месте проведения клинических исследований в течение 10 рабочих дней с момента утверждения плана клинических исследований.
Целью этого этапа является подтверждение эффективности препарата при заявленных показаниях и его безопасности при применении в соответствии с инструкцией. Только после этого можно начать процедуру государственной регистрации лекарственного препарата.
Четвертый этап – регистрация ветпрепарата
Регистрацией лекарственных средств для ветеринарного применения занимается Россельхознадзор. В соответствии со ст. 17 Федерального закона № 61 разработчик должен направить в Россельхознадзор заявление о государственной регистрации лекарственного препарата для ветеринарного применения, а также предоставить необходимый пакет документов, из которых формируется регистрационное досье на лекарственный препарат.
На официальном сайте Россельхознадзора опубликован перечень необходимых документов и бланк заявления. После получения от заявителя полного пакета документов Россельхознадзор направляет задание в подведомственный ему ФГБУ «ВГНКИ».
Специалисты центра проверяют документы заявителя и образцы лекарственного препарата. По итогам проверки ВГНКИ направляет в Россельхознадзор заключение с результатами проверки, на основании которых ведомство либо регистрирует препарат для ветеринарного применения, либо отказывает в регистрации.
Пятый этап – производство ветпрепарата
Каждое предприятие, которое выпускает лекарственный препарат для ветеринарного применения, должно соответствовать всем требованиям и иметь необходимые для этого лицензии и аттестаты. Также с 2021 года вступили в силу Правила надлежащей производственной практики Евразийского экономического союза (ЕАЭС). Выдача заключений о соответствии производителя лекарственных средств требованиям Правил надлежащей производственной практики (правилам GMP) осуществляется по результатам инспектирования специалистами ВГНКИ.
Шестой этап – ввод в обращение
Для получения разрешения Россельхознадзора о вводе ветеринарного препарата в оборот производитель должен направить в службу заявку и пакет документов, среди которых: – документ, подтверждающий качество лекарственного препарата для ветеринарного применения; – подтверждение уполномоченного лица производителя.
Для препаратов, ввозимых из третьих стран или перемещаемых внутри ЕАЭС, также прикладываются заключение на соответствие требованиям GMP и, для первых двух серий, протоколы испытаний аккредитованных лабораторий.
Для фармакологических лекарственных препаратов указанные документы предоставляются в Россельхознадзор в уведомительном порядке. А для иммунологических лекарственных препаратов необходимо получение разрешения Россельхознадзора, которое действует 3 года. Вся информация о порядке выдачи размещена на официальном сайте Россельхознадзора.
Седьмой этап – выборочный контроль качества лекарственного препарата для ветеринарного применения
После ввода ветпрепарата в обращение специалисты территориальных управлений Россельхознадзора осуществляют выборочный контроль качества ветеринарного препарата.
Порядок осуществления выборочного контроля утвержден приказом Россельхознадзора № 605. Отбор контрольных образцов ветпрепаратов производится в зоомагазинах, животноводческих хозяйствах, оптовых фирмах, а также непосредственно у самих производителей. Затем отобранные образцы отправляются в ВГНКИ для проведения испытаний на соответствие требованиям нормативного документа в рамках выборочного контроля качества.
По результатам испытаний специалисты ВГНКИ направляют протокол испытаний в Россельхознадзор.
На основании экспертного заключения Россельхознадзор направляет субъекту обращения лекарственных средств письмо о подтверждении качества либо о приостановлении обращения в случае несоответствия/нарушений качества.
Восьмой этап – фармаконадзор
Для получения максимально объективной и точной информации о реакциях животных на лекарственный препарат Россельхознадзор собирает и обрабатывает данные на территории всей страны. Полученная информация анализируется в Россельхознадзоре и передается в Службу мониторинга подведомственного учреждения ВГНКИ.
Эксперты ВГНКИ анализируют информацию о препаратах, вызывающих нежелательную реакцию, устанавливают причинно-следственные связи, оценивают распространенность нежелательных реакций.
Далее формируют и направляют предложения в Россельхознадзор по актуальным проблемам в области фармаконадзора и вопросам, связанным с эффективностью и безопасностью лекарственного препарата, а также предложения по минимизации нежелательных реакций при обращении лекарственных препаратов.
По материалам Ветеринария и жизнь