16 декабря представители регуляторов из ЕЭК, GMP-инспекторатов России и Армении, эксперты ISPE и производители оборудования для фармацевтических предприятий в рамках предконференции Евразийского отделения ISPE обсудили регуляторные тенденции производства лекарственных средств в ЕАЭС и мире. Партнером тематической сессии выступил международный производитель промышленного и лабораторного оборудования для фармацевтической отрасли – ООО «Сарториус Стедим РУС».
 Последние месяцы в ленте отраслевых СМИ регулярно появляются материалы об изменениях, касающихся единого фармацевтического рынка ЕАЭС. Что это несет производителям лекарственных средств и к чему еще им предстоит готовиться, рассказал на предконференции ISPE ЕАЭС начальник отдела координации работ в сфере обращения лекарственных средств и медицинских изделий департамента технического регулирования и аккредитации ЕЭК Дмитрий Рождественский. Спикер представил 18 актов ЕЭК по обращению лекарственных средств, которые были приняты на заседаниях Коллегии и Cовета комиссии в 2020 г. Эти нормативные акты касаются всех типов лекарственных средств (начиная от субстанций и заканчивая БМКП).
Последние месяцы в ленте отраслевых СМИ регулярно появляются материалы об изменениях, касающихся единого фармацевтического рынка ЕАЭС. Что это несет производителям лекарственных средств и к чему еще им предстоит готовиться, рассказал на предконференции ISPE ЕАЭС начальник отдела координации работ в сфере обращения лекарственных средств и медицинских изделий департамента технического регулирования и аккредитации ЕЭК Дмитрий Рождественский. Спикер представил 18 актов ЕЭК по обращению лекарственных средств, которые были приняты на заседаниях Коллегии и Cовета комиссии в 2020 г. Эти нормативные акты касаются всех типов лекарственных средств (начиная от субстанций и заканчивая БМКП).
Представитель ЕЭК рассказал и о ближайших изменениях в части правил регистрации препаратов в 2020-2021 гг., среди которых:
- Продление до 31.12.2024 возможности представить GMP-сертификат государства-члена ЕАЭС, а также возможности выполнения GMP-инспекции в процессе регистрации или в течение 3 лет после регистрации, если не представлен сертификат GMP
- Возможность внесения изменений в досье лекарственных препаратов, зарегистрированных по национальным процедурам до 12.2025
- Указание формы упаковки нерасфасованного (in bulk) лекарственного препарата.
Указанные изменения планируется принять в I-II кварталах 2021 г.
 В предконференции Евразийского отделения ISPE приняли участие и представители GMP-инспекторатов. Руководитель отдела по инспектированию надлежащих фармацевтических практик Научного центра экспертизы лекарств и медицинских технологий Министерства здравоохранения им. академика Эмиля Габриэляна (Республика Армения) Мкртыч Шакарян дал практические советы по применению нормативно-правовых актов ЕАЭС в сфере GM(D)P и отметил, что GEP охватывает весь жизненный цикл лекарственного препарата от идеи, разработки до вывода на рынок. Заместитель начальника ОЭ ФБУ «ГИЛС и НП» Минпромторга России Надежда Архипова, представляя анализ Проекта Руководства ЕАЭС по асептическим процессам в производстве стерильных лекарственных препаратов, отметила, что в Проекте Руководства в дополнение к Правилам надлежащей производственной практики для производства стерильных лекарственных средств более подробно рассматриваются выполняемые в асептических условиях такие технологические и вспомогательные процессы как стерилизующая фильтрация; розлив; лиофилизация; использование изоляторов; BFS; CIP/SIP, APS. Исходя из положений Руководства применительно к существующим тенденциям, выявляемым в ходе инспекций, спикер обратила внимание в т. ч. на особенности проектирования «чистых» помещений. Говоря об оборудовании, Надежда Архипова указала, что в зоне асептического процесса оно должно размещаться таким образом, чтобы облегчить доступ к нему оператора и обслуживающего персонала и свести к минимуму возможность контакта компонентов первичной упаковки и продукта с окружающей производственной средой.
В предконференции Евразийского отделения ISPE приняли участие и представители GMP-инспекторатов. Руководитель отдела по инспектированию надлежащих фармацевтических практик Научного центра экспертизы лекарств и медицинских технологий Министерства здравоохранения им. академика Эмиля Габриэляна (Республика Армения) Мкртыч Шакарян дал практические советы по применению нормативно-правовых актов ЕАЭС в сфере GM(D)P и отметил, что GEP охватывает весь жизненный цикл лекарственного препарата от идеи, разработки до вывода на рынок. Заместитель начальника ОЭ ФБУ «ГИЛС и НП» Минпромторга России Надежда Архипова, представляя анализ Проекта Руководства ЕАЭС по асептическим процессам в производстве стерильных лекарственных препаратов, отметила, что в Проекте Руководства в дополнение к Правилам надлежащей производственной практики для производства стерильных лекарственных средств более подробно рассматриваются выполняемые в асептических условиях такие технологические и вспомогательные процессы как стерилизующая фильтрация; розлив; лиофилизация; использование изоляторов; BFS; CIP/SIP, APS. Исходя из положений Руководства применительно к существующим тенденциям, выявляемым в ходе инспекций, спикер обратила внимание в т. ч. на особенности проектирования «чистых» помещений. Говоря об оборудовании, Надежда Архипова указала, что в зоне асептического процесса оно должно размещаться таким образом, чтобы облегчить доступ к нему оператора и обслуживающего персонала и свести к минимуму возможность контакта компонентов первичной упаковки и продукта с окружающей производственной средой.
Оборудование, требующее частого вмешательства оператора или обслуживающего персонала, должно размещаться в удалении от критических производственных зон.
Значения температуры и, при необходимости, относительной влажности воздуха следует определять, контролировать и регулировать таким образом, чтобы выполнялись требования к сохранению качества производимого продукта и обеспечению комфорта персонала.
Оптимальными для условий асептического процесса, если не обосновано иное, считаются следующие диапазоны показателей: температура от 19ºС до 21ºС, относительная влажность воздуха от 40% до 50%, — пояснила эксперт, ссылаясь на положения Проекта Руководства.
Нововведения в руководстве также ожидаются и в отношении моделирования асептических процессов (APS). Ожидается, что в новом документе будут приведены более детальные указания относительно периодичности проведения APS относительно рабочих смен операторов в целом и каждого оператора в частности.
 Не обошла стороной в своей презентации эксперт и вопросы валидации процессов депирогенизации, которые на сегодняшний день лишь упомянуты в действующей редакции Приложения №1 к правилам GMP. Как пояснила Надежда, в проекте Руководства указаны конкретные критерии оценки эффективности процессов депирогенизации при их валидации.
Не обошла стороной в своей презентации эксперт и вопросы валидации процессов депирогенизации, которые на сегодняшний день лишь упомянуты в действующей редакции Приложения №1 к правилам GMP. Как пояснила Надежда, в проекте Руководства указаны конкретные критерии оценки эффективности процессов депирогенизации при их валидации.
В Руководства ЕАЭС по асептическим процессам в производстве стерильных лекарственных препаратов содержатся рекомендации и к микробиологическому мониторингу персонала. Отбор проб с поверхности перчаток и с других участков одежды выполняется для каждого оператора сразу после выполнения им критических технологических операций для каждой произведенной серии продукта. А вот практика дезинфекции перчаток непосредственно перед отбором проб неприемлема, поскольку это может препятствовать росту микроорганизмов, присутствовавших во время асептических манипуляций, и не позволяет своевременно их обнаружить.
Результаты анализа отобранных проб следует использовать для выявления тенденций в изменении уровня микробной контаминации и оценки необходимости повторной подготовки персонала, — обратила внимание участников предконференции ISPE ЕАЭС Надежда Архипова.
Говоря о контроле окружающей производственной среды, спикер дала рекомендацию выполнять отбор проб с критических поверхностей после завершения асептического процесса, чтобы избежать прямого контакта персонала и оборудования для отбора проб со стерильными поверхностями во время процесса. «При обнаружении единичных контаминированных проб, отобранных с критического участка производственной зоны, проводится расследование. Обнаружение микробного загрязнения на критическом участке производственной зоны не означает, что серия лекарственного препарата обязательно может быть забракована, но при расследовании следует выполнить оценку риска для качества серии лекарственного препарата», — подчеркнула представитель «ГИЛС и НП».
В ходе выступления Надежда Архипова акцентировала внимание слушателей на положения Проекта Руководства о том, что поскольку разные приборы для отбора проб различаются между собой, для контроля содержания микроорганизмов в воздухе производитель должен проводить оценку общей пригодности устройства для мониторинга содержания микроорганизмов в воздухе до его ввода в эксплуатацию. Также необходимо гарантировать, что такие устройства откалиброваны и используются в соответствии с установленными на производстве надлежащими процедурами.
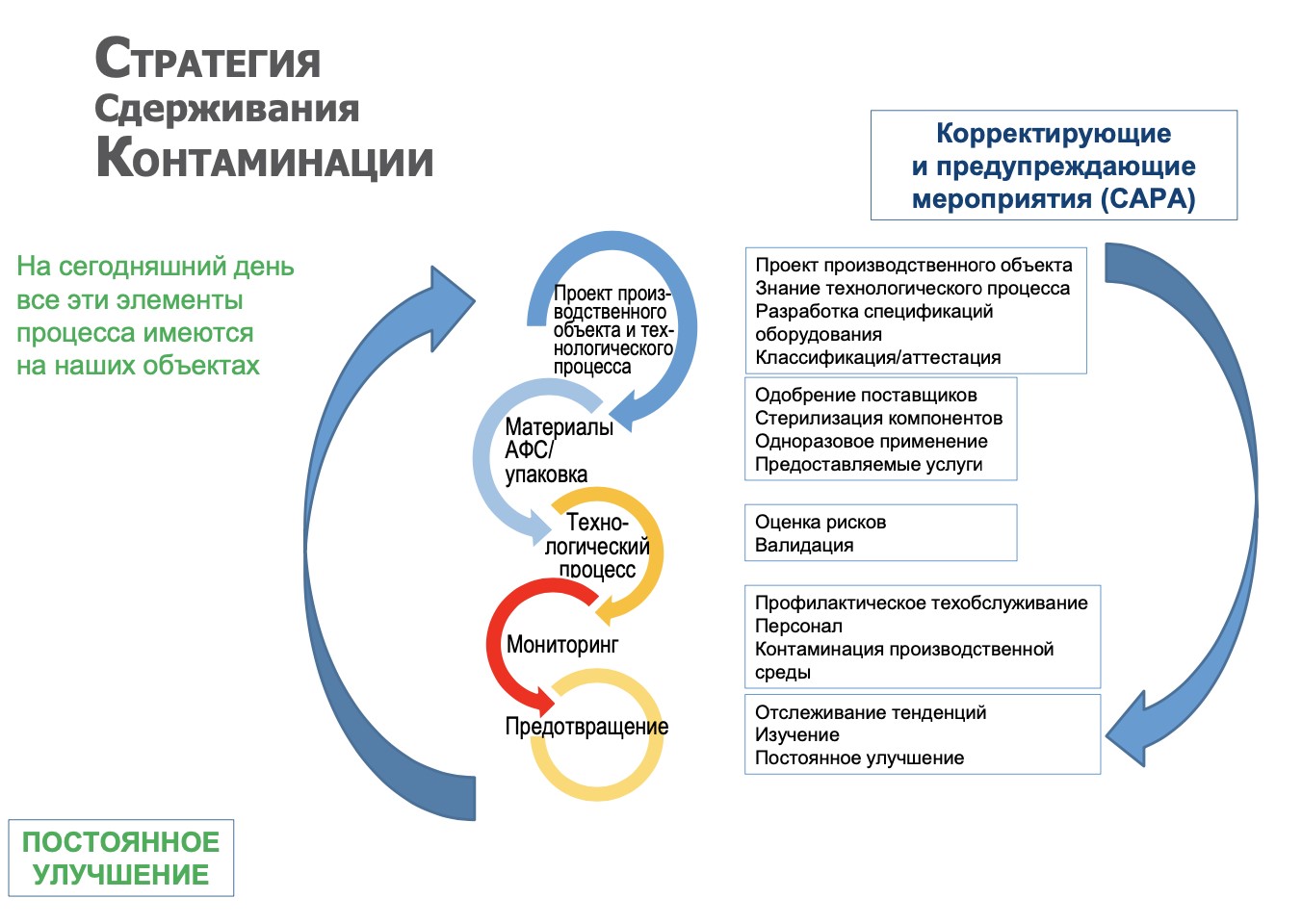
 В рамках сессии «Совершенствование нормативной базы производства ЛС в ЕАЭС и мире и текущие регуляторные тенденции» участники предконференции ISPE ЕАЭС познакомились с основными моментами пересмотра Приложения №1 GMP ЕС. Действие данного документа распространяется как на производство стерильных ЛП, так и стерильных АФС. «Указанный документ можно также использовать в качестве вспомогательного руководства при производстве другой продукции, стерильность которой не требуется, если при этом контроль контаминации микроорганизмами, частицами и пирогенами с целью их снижения до минимума считается важным аспектом (крема, мази, активные фармацевтические субстанции)», — отметил старший эксперт по регуляторным вопросам, директор локального отделения ISPE Франции Жан Франсуа Дюльер. Существенное внимание в Приложении 1 GMP ЕС уделяется вопросам Стратегии Сдерживания Контаминации, элементы которой представлены на рисунке ниже:
В рамках сессии «Совершенствование нормативной базы производства ЛС в ЕАЭС и мире и текущие регуляторные тенденции» участники предконференции ISPE ЕАЭС познакомились с основными моментами пересмотра Приложения №1 GMP ЕС. Действие данного документа распространяется как на производство стерильных ЛП, так и стерильных АФС. «Указанный документ можно также использовать в качестве вспомогательного руководства при производстве другой продукции, стерильность которой не требуется, если при этом контроль контаминации микроорганизмами, частицами и пирогенами с целью их снижения до минимума считается важным аспектом (крема, мази, активные фармацевтические субстанции)», — отметил старший эксперт по регуляторным вопросам, директор локального отделения ISPE Франции Жан Франсуа Дюльер. Существенное внимание в Приложении 1 GMP ЕС уделяется вопросам Стратегии Сдерживания Контаминации, элементы которой представлены на рисунке ниже:
Продолжая эту тему, ведущий специалист по лабораторной фильтрации и микробиологии Sartorius Марина Капранова сделала упор на анализе минимизации рисков контаминации в производстве стерильных медицинских средств, рекомендации по которой также содержатся в Приложении 1 GMP ЕС.
Возникает смешивание понятий “continuous” (непрерывный) и “frequentative” (частый), — обратила внимание спикер. — Такая интерпретация – из-за процесса замены чашек с агаром (по методу импакции), который, по сути, даёт возможность “частого” контроля. Классический метод импакции ограничен максимум 2-3 часами. Для “непрерывного” контроля можно использовать другой метод отбора пробы — на желатиновые фильтры (до 8 часов).
 В Sartorius убеждены, что обычная замена чашек с агаром при импакции – это вмешательство, а значит, потенциальный риск контаминации, поэтому при замене чашек с агаром такое действие должно быть также охвачено контролем. В качестве альтернативы предлагается использование метода желатиновых фильтров (GMF). Данный метод, по мнению спикера, обладает рядом преимуществ, в числе которых:
В Sartorius убеждены, что обычная замена чашек с агаром при импакции – это вмешательство, а значит, потенциальный риск контаминации, поэтому при замене чашек с агаром такое действие должно быть также охвачено контролем. В качестве альтернативы предлагается использование метода желатиновых фильтров (GMF). Данный метод, по мнению спикера, обладает рядом преимуществ, в числе которых:
- в отличие от импакции, задерживание микроорганизмов не зависит от их массы / инерции частиц, задерживаемых на отбирающем материале;
- возможность обнаружить даже малое число КОЕ, поскольку отбор 1 м³ воздуха происходит за короткий промежуток времени;
- поддержание изокинетических условий отбора проб в ламинарных потоках (благодаря регулировке скорости потока воздуха);
- применимость в критических точках чистых помещений класса A/B (линии наполнения), линиях выдув-надув-запайки и изоляторах
и ряд других.
Еще один представитель компаний, специализирующихся на производстве и поставке оборудования и расходных материалов для микробиологического контроля, руководитель фармацевтического направления ООО «Биомерье Рус» Руслан Андрианов познакомил участников предконференции ISPE ЕАЭС с альтернативными методами в микробиологическом контроле качества.
Внедрение альтернативных методов — мировой регуляторный тренд, основанный на современных потребностях фарминдустрии, — подчеркнул спикер, представляя решения ООО «Биомерье Рус», разработанные в соответствие с альтернативными микробиологическими методами, описанными в 14-й ГФ РФ, Фармакопее ЕС и USP.
Регуляторная сессия предконференции Евразийского отделения ISPE вызвала большой интерес зрителей, которые имели возможность задать спикерам вопросы. «К сожалению, мы были ограничены жестким временным таймингом эфира, потому не на все вопросы успели ответить. Сейчас мы рассматриваем несколько вариантов, как организовать обратную связь: некоторые вопросы станут темами I Ежегодной конференции ISPE ЕАЭС, которую мы проведем в оффлайн-формате в 2021 году; ответы на другие мы разместим на официальном сайте Евразийского отделения ISPE (ispe.ru)», — сообщил, подводя итоги сессии, директор ISPE ЕАЭС Владимир Орлов.
Генеральным партнером предконференции Евразийского отделения ISPE выступил вертикально интегрированный российский холдинг – ГК «ФармЭко», работающий в 3 сегментах фармацевтического рынка: разработка, производство и дистрибуция лекарственных препаратов и медицинского оборудования. Официальным партнером стал российский системообразующий высокотехнологичный фармацевтический производственный комплекс — АО «Татхимфармпрепараты». Партнерами мероприятия также выступают: итальянская компания PQE Group, специализирующаяся на консультировании и экспетизе в фармацевтической сфере; дистрибьютор технологического и лабораторного оборудования – компания Gluvex; ООО «НТФФ «ПОЛИСАН», входящий в ТОП-10 крупнейших российских производителей лекарственных средств; фармацевтическая компания полного цикла, ориентированная на разработку и производство широкого спектра лекарственных средств для лечения социально значимых заболеваний и удовлетворения нужд пациентов Российской Федерации, — ООО «НАТИВА»; филиал компании bioMérieux в России — ООО «биоМерье Рус». Организатор – МАФИ ЕАЭС, генеральным партнером которой является ГК «Р-Фарм». Технические операторы – компании «Экспирос» и «Международный Центр Инновационных Программ»


