
Первый МГМУ им. И.М. Сеченова,
доцент кафедры Промышленной фармации
Хранение является одним из основных процессов обращения лекарственных средств. При организации надлежащего хранения прежде всего необходимо, чтобы оснащение складских зон и условия их эксплуатации обеспечивали поддержание необходимых температурных режимов в установленных пределах. Несоблюдение этих условий может приводить к потере качества лекарственных средств и является грубым нарушением лицензионных требований.
Температурные отклонения могут привести к изменению состава или физических свойств лекарственного средства (образованию осадка, изменению окраски или агрегатного состояния). Особенно опасно, когда вследствие нарушения условий хранения, внешний вид лекарственного средства не претерпевает каких-либо изменений, но при исследовании обнаруживаются примеси продуктов разложения, отличающиеся токсичностью или иным отрицательным фармакологическим действием. Вот почему поддержание установленной температуры в местах хранения и транспортирования (наряду с остальными условиями) является краеугольным камнем обеспечения качества лекарственных средств.
Требования к помещениям для хранения регулируются международным и национальным законодательством [1-7] и в основном сводятся к поддержанию установленного интервала температуры и влажности. В исключительных случаях этот интервал может дополняться периодами кратковременного отклонения температуры до определенного значения [6], или расчетом средней кинетической температуры, которая может оправдать выход температуры за установленный производителем диапазон температуры хранения [8,9].
Соблюдение установленного интервала температуры хранения лекарственных средств является самым распространенным и простым способом организации мест хранения и методом контроля за соблюдением в помещении установленного температурного режима. В этом случае обеспечивается единство требований к местам хранения (транспортным средствам), независимо от места расположения помещения и географии поставок.
Однако на практике мы, зачастую, сталкиваемся с кратковременным выходом температуры за установленный интервал, как при хранении, так и в ходе транспортирования. В большей степени это наблюдается при организации логистических процессов (погрузка, разгрузка, перемещение в процессе хранения и транспортирования).
Типичный пример:
Выгрузка лекарственных препаратов с температурой хранения +2…+8°С из транспортного средства в места размещения для хранения через помещение с комнатной температурой +15…+25°С.
Лекарственные средства фактически (хотя и непродолжительное время) находились при температуре, которая отличается от установленной.
Считается ли это нарушением температурного режима?
Чем руководствоваться оператору процесса загрузки холодильной камеры в таком случае?
Безусловно, такой случай должен подвергаться тщательному расследованию со стороны субъекта обращения и производителя этого лекарственного средства. Но ввиду огромного ассортимента в организации оптовой торговли появление таких случаев приобретает массовый характер и приводит к усложнению грузопереработки, увеличению ее себестоимости, и как следствие уменьшению прибыли.
Средняя кинетическая температура (МКТ)
Для лучшего понимания влияния температурных отклонений при хранении и транспортировке лекарственных препаратов некоторые авторы [10] предлагают использовать расчет средней кинетической температуры или Mean Kinetic Temperature (МКТ), который используется при испытаниях стабильности лекарственных средств [8,9].
Средняя кинетическая температура (МКТ) – это рассчитанная температура, при которой (если ее поддерживают в течение определенного периода времени) обеспечивается такое же тепловое воздействие на лекарственное вещество или лекарственный препарат, как воздействие в диапазоне более высоких или более низких температур в течение эквивалентного заданного периода. Средняя кинетическая температура выше средней арифметической температуры и рассчитывается с учетом уравнения Аррениуса [8].
Шведский химик, лауреат Нобелевской премии по химии (1903) Сванте Август Аррениус (Svante August Arrhenius) установил зависимость константы скорости химической реакции k от температуры T:
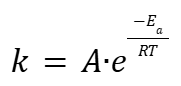 |
(1) |
где:
k — константа скорости химической реакции;
A — пред экспоненциальный множитель;
e — основание натурального логарифма;
Ea — энергия активации;
R — молярная газовая постоянная;
T — абсолютная температура.
Благодаря уравнению Аррениуса можно упрощенным способом рассчитать МКТ.
Пусть рассматриваемый временной период △Т состоит из n временных интервалов △Т1, △Т2, … △Тn.
| (2) |
Снижение концентрации активного вещества в рассматриваемый период △Т будет выражаться следующей зависимостью:
| (3) |
Скорость химической реакции, при которой происходит снижение концентрации в каждый период времени n выражается зависимостью:
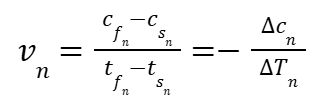 |
(4) |
где:
| — концентрация вещества в начале периода △Tn; | |
| — концентрация вещества в конце периода △Tn; | |
| — время начала периода △Tn; | |
| — время окончания периода △Tn. |
Скорость химической реакции vср для всего рассматриваемого периода △Т будет выражаться зависимостью:
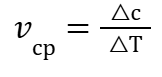 |
(5) |
Воспользовавшись выражениями (2), (3), (5) можем записать:
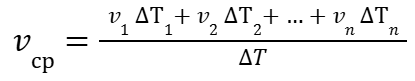 |
(6) |
Для выражения (2) мы можем выбрать такое ∆Tед, что будет справедливо выражение:
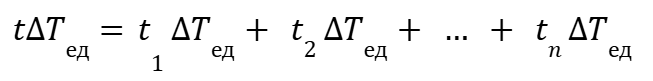 |
(7) |
где:
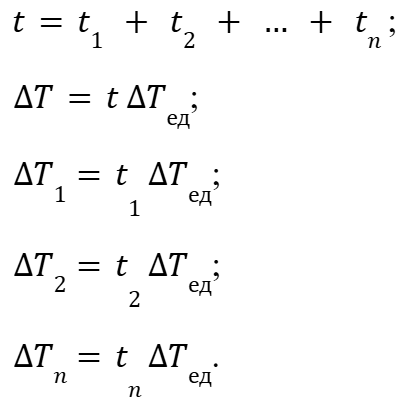
тогда
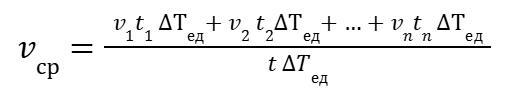 |
(8) |
или
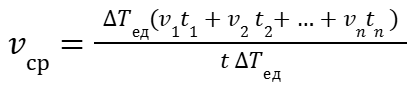 |
(9) |
сократив ∆Тед получим:
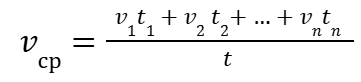 |
(10) |
Можно заметить, что при
| (11) |
Средняя скорость химической реакции упрощается до выражения:
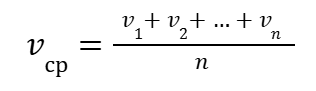 |
(12) |
Для того, чтобы связать скорость v с константой скорости химической реакции k, необходимо воспользоваться основным постулатом химической кинетики (13):
| (13) |
где
v — скорость химической реакции;
k — константа скорости химической реакции;
CaA и CbB — концентрации реагирующих веществ.
Если учесть, что CaA и CbB = const, выражение (10) примет вид:
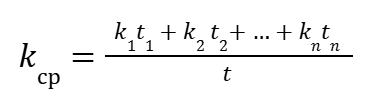 |
(14) |
Используя уравнение Аррениуса (1), можно записать его для средней кинетической температуры Тмкт :
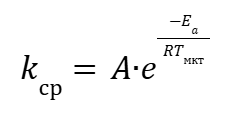 |
(15) |
Преобразовав выражение (15) получаем:
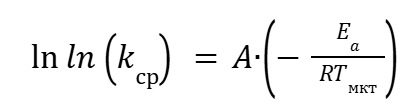 |
(16) |
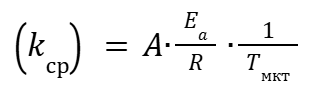 |
(17) |
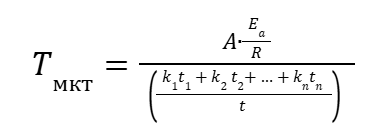 |
(18) |
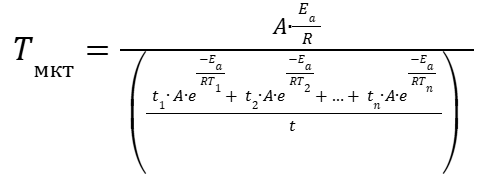 |
(19) |
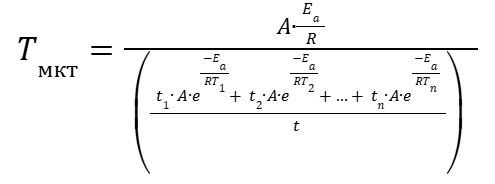 |
(20) |
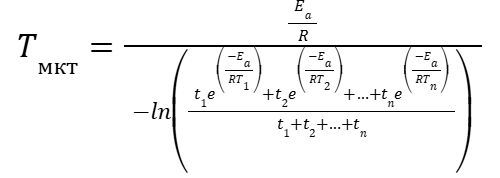 |
(21) |
И для частного случая (11), когда температура наблюдалась в равные промежутки времени, можно записать.
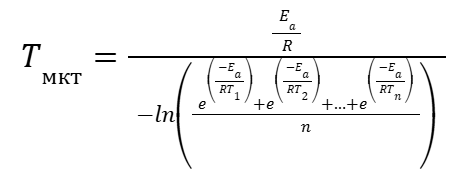 |
(22) |
где
Tмкт — средняя кинетической температура;
Ea — энергия активации;
R — молярная газовая постоянная (8,314 Дж/моль۰К);
Ti — абсолютная температура в каждом i -ом промежутке времени;
n — количество равных промежутков времени, где Ti – const.
Полученная зависимость (21), (22) позволяет определить среднюю кинетическую температуру.
Можно ли использовать расчет МКТ для обоснования кратковременных отклонений?
Сторонники положительного ответа на этот вопрос, приводят работу американских ученых [10] опубликованную в 2009 году (Pharmaceutical Outsourcing May/June 2009).
В этой работе для расчета МКТ для всех лекарственных препаратов предлагается использовать усредненное значения энергии активации Ea – основного проблемного элемента в уравнении МКТ (22).
В первом примере, для приведенной годовой статистики температур двух режимов хранения (без значительных отклонений от нормы!), авторы рассчитывают МКТ с различными значениями энергии активации (Таблица 1).
![Расчет средней кинетической температуры при обосновании кратковременных отклонений 29 Таблица 1. Значения МКТ для модели изменения температуры во времени для различных энергий активации. Источник: [10]](https://pharmprom.ru/wp-content/uploads/2025-03-19_15-13-05.png)
Если разница в расчетах так мала, то авторы предлагают взять значение энергии активации для дальнейших расчетов Ea = 83,144 кДж/моль, вероятно для того, чтобы Ea/R в формуле (22) принимало удобное для дальнейших расчетов значение (10 000), и приступают к дальнейшим вычислением.
Во втором примере они вновь рассчитывают МКТ для той же статистики, но уже со значительными отклонениями, выходящими за установленные пределы (температура в каждом случае 2 раза принимала значения на 20 градусов выше от среднего), и получают вполне приемлемые результаты (Таблица 2).
![Расчет средней кинетической температуры при обосновании кратковременных отклонений 30 Таблица 2. Расчетные значения MKT для сегментов модели срока годности лекарства. Источник: [10]](https://pharmprom.ru/wp-content/uploads/2025-03-19_15-27-16.png)
В этом, безусловно, и состоит привлекательность этой методики.
Но авторы по какой-то причине не учли, как будет изменяться значение МКТ при различных значениях энергии активации во втором примере, когда происходят значительные отклонения температуры хранения.
Если выполнить такой расчет в условиях второго примера для Ea = 250 кДж/моль (Таблица 3) и сравнить его с результатом усредненного Ea = 83,144 кДж/моль (Таблица 2), то обнаружиться несостоятельность предлагаемой авторами методики.
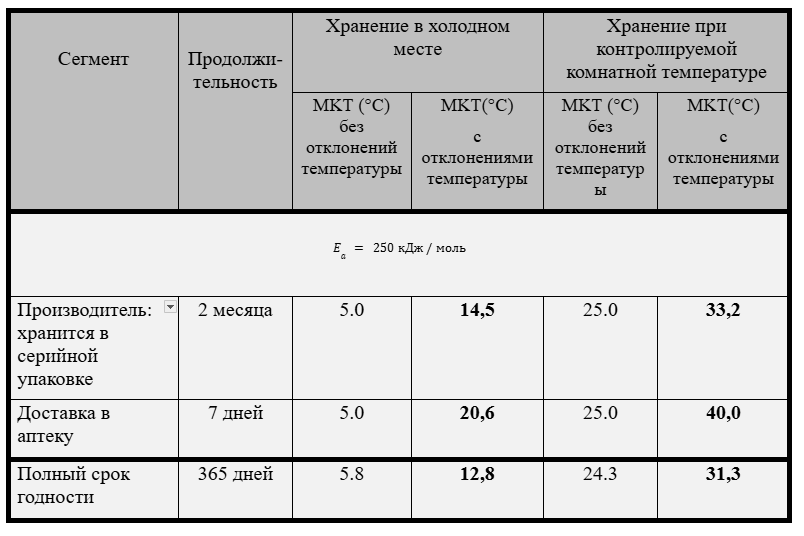
На мой взгляд, в работе сделан поспешный вывод о слабом влиянии энергии активации на значения средней кинетической температуры (МКТ).
Это влияние наименьшее при слабом отклонении температуры от средних значений и увеличивается при резком кратковременном увеличении температур (т.н. выброс температуры), для которых и предполагалось использовать представленную в работе [10] методику.
Заключение
Расчёт средней кинетической температуры (МКТ) — это упрощенный способ выражения общего влияния колебаний температуры при хранении и транспортировании. Большой ряд условностей в лучшем случае усложняет ее расчет, а в худшем — делает непригодной для применения.
Во-первых, формула рассматривается только кинетическую (поступательную) энергию молекул, другие виды энергии (электронная, колебательная, вращательная) в расчет не берутся.
Во-вторых, она применима только к простейшим реакциям, а современные лекарственные средства — это сложные по составу и природе вещества (различные по типу химических связей в молекулах реагентов, прочности связей, строению кристаллической решетки, строению электронной оболочки атома, прочности связывания внешних электронов и др).
В-третьих, энергия активации Ea – это эмпирическая величина, которая определяется опытным путем и требует специальных знаний, навыков и оборудования для ее определения.
Ну и, в-четвертых. Можно прислушаться к словам нобелевского лауреата по химии (катализ, химические равновесия, скорости реакций) Вильгельма Фридриха Оствальда, которому приписываются такие слова «температурная зависимость скоростей химических реакций — одно из самых темных мест в химической механике» [14]. А доверять качество лекарственного средств «темным местам», думаю, не предоставляется возможным.
Поэтому определение средней кинетической температуры не может дать однозначного ответа о качестве лекарственного средства, которое при хранении подверглось температуре, отличной от рекомендованной производителем. Решение этого вопроса требует дальнейших поисков методов обоснования влияния температуры на качество лекарственных средств при хранении (транспортировании).
Литература:
- Решение от 3 ноября 2016 года № 77 Совета Евразийской экономической политики. «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза»
- Решение Совета Евразийской экономической комиссии от 03.11.2016 №80 «Об утверждении Правил надлежащей дистрибьюторской практики в рамках Евразийского экономического союза»
- Приказ от 14 июня 2013 г. № 916 Министерства промышленности и торговли Российской федерации «Об утверждении правил надлежащей производственной практики»
- Приказ Минздрава России от 31.08.2016 №646н «Об утверждении Правил надлежащей практики хранения и перевозки лекарственных препаратов для медицинского применения»
- Государственная фармакопея Российской Федерации (ГФ РФ) XV издание, 2023 г.
- United States Pharmacopeia USP 43–NF 38
- European Pharmacopoeia 9.0
- Решение Коллегии Евразийской экономической комиссии от 10.05.2018 г. № 69 «Об утверждении Требований к исследованию стабильности лекарственных препаратов и фармацевтических субстанций»
- ICH Q1A «Stability testing of new drug substances and products», IDT
- The use of mean kinetic temperature (MKT) in the handling, storage, and distribution of temperature sensitive pharmaceuticals. Robert H. Seevers, Ph.D., Rafik H. Bishara, Ph.D., Paul Harber, Dave Ulrich, Jeffrey Hofer Pharmaceutical Outsourcing May | June 2009.
- Грейбо С.В., Петросян Э.А. «Контроль температурного режима хранения лекарственных средств в помещениях большого объема» Научно-аналитический журнал «Логистика и управление цепями поставок» № 3 (62) июнь 2014 г.
- Rationale for the Necessity of Temperature Mapping of Storage Areas for Pharmaceutical Products Natalia Valeryevna Pyatigorskaya, Valery Vasilyevich Beregovykh, Vasily Viktorovich Belyaev, Sergey Vladimirovich Greibo, Alexander Mikhaylovich Pyatigorskiy. Sechenov First Moscow State Medical University, 119991, Russia, Moscow, Trubetskaya str., 8/2
- Reducing the Number of Temperature Sensing Devices during Performance of Temperature Mapping N.V. Pyatigorskaya, V. V. Beregovykh, V. V. Belyaev, S. V. Greibo, A. M. Pyatigorskiy Sechenov First Moscow State Medical University, 119991, Russia, Moscow, Trubetskaya Str., 8/2
- Chemical Kinetics and Mechanism, M Mortimer, P G Taylor, Royal Society of Chemistry 7/18/2002, 2002


