Доклад посвящен новым подходам фармацевтических компаний, лидеров фармацевтического рынка США И ЕС, к организации входного, межоперационного и приемочного контроля качества лекарств. Подход основан на использовании многофакторного планирования экспериментов, управлении рисками еще на стадии разработки продукта, на статистическом управлении процессами и выпуске по параметрам (т.е. принятие решения о качестве не на основании приемочного контроля выборки, а по значениям параметров оборудования)
Что такое «Big Pharma»?
Термин «Большая Фарма» означает коллегиальное образование, в состав которого входят ведущие мировые производители в основном инновационных лекарств. К таким компаниям относятся Pfizer, Novartis, AstraZeneca, Merck и др. Большая фарма – это нечто больше, чем бизнес-модель, построенная на крупных рынках и доходах от блокбастеров. Менеджеры корпораций, входящих в Ассоциации производителей фармацевтической продукции США и Великобритании, считающихся ядром Большой Фармы, традиционно имеют огромное влияние на развитие законодательной базы в фармацевтической отрасли и тенденции ее мировой гармонизации. Именно представители Pfizer, Merck&Co, Novartis, Bristol-Myers Squibb Co., Eli Lilly и др. гигантов входят в рабочие комитеты ICH, FDA, участвуют в совершенствовании законодательной базы Евросоюза, России, Казахстана и Украины.
Государственная политика всех без исключения стран СНГ декларирует принципы создания и развития эффективного отечественного фармацевтического производства. Но и цена входа новой компании на этот рынок продолжает расти. Уровень расходов на создание, государственную регистрацию и обеспечение выпуска коммерческих серий лекарственных средств настолько велик, что любые проблемы с качеством просто недопустимы, так как могут стоить компании всего ее будущего. Принимая ту или иную стратегию, каждая компания выбирает свой путь, но какой бы путь она не выбрала, качество (а это прежде всего эффективность, безопасность и соответствие лекарства заявленной спецификации) было и остается одним из основных факторов успешности фармацевтического бизнеса.
Очевидно, на этом фоне отечественным специалистам будет интересно оценить тенденции развития современной (или как ее уже величают, инновационной) стратегии качества выпускаемых лекарств, которую исповедуют лидеры мирового фармацевтического рынка.
Традиционный контроль качества
Отечественная система контроля качества лекарственных препаратов стоит на трех китах – входной контроль, межоперационный (или как часто называют, внутрипроизводственный) и приемочный контроль готовой продукции. Именно на этой модели работает 100% всех отечественных предприятий стран бывшего СССР. И традиционно, ответственность за поддержание такой системы полностью возложена на службу качества предприятия.
Входной контроль проводится для всех поступающих серий исходного сырья (активные субстанции и вспомогательные вещества). При этом объем входного контроля включает все без исключения показатели спецификации (ГОСТ, ОСТ, ТУ или внутренний норматив) независимо от назначения того или иного вещества в лекарственной форме препарата. Лабораторные испытания проводятся в аккредитованных государственных или аттестованных производственных лабораториях, зачастую дублируя друг друга. В соответствии с требованиями Приложения 8 GMP аналитический тест на подлинность проводится для каждого тарного места в серии сырья. На основании результатов лабораторного контроля Уполномоченное Лицо принимает решение о возможности использования каждой серии сырья в производстве.
Объем межоперационного контроля, как правило, определяется технологом, разрабатывающим технологическую документацию, согласовывается службой качества и руководителем производственного участка. Вопросы обеспечения репрезентативности пробы и условия ее транспортирования (хранения) зачастую остаются незамеченными. Основной акцент ставится на необходимости контроля максимально возможного числа параметров процесса и качества продуктов. При этом все решения, связанные с несоответствующей продукцией может принимать только Уполномоченное Лицо. Это связано с тем, что одним из ключевых принципов GMP декларируется независимость службы качества от службы производства.
Приемочный контроль осуществляется после окончания всех производственных операций. Такой контроль включает лабораторные испытания контрольных образцов, отобранных из предъявленной серии лекарственного препарата и оценку досье серии (подборка всех записей (протоколы, журналы), которые велись в ходе всего производственного процесса). Серия может быть выпущена на рынок (отправлена потребителю) только после письменного разрешения Уполномоченного Лица.
Такая организация контроля характеризуется отсутствием гибкости, избыточными испытаниями и большими потерями ресурсов. Однако по мнению большинства регуляторных органов стран бывшего СССР это с лихвой компенсируется качеством выпускаемой на отечественных предприятиях продукции.
Контроль качества, основанный на оценке риска
Одной из ярких тенденций последних лет является стремление увлечь специалистов фармацевтических предприятий в мир управления рисками. Этот мир позволяет упростить и уменьшить количество хаотичных движений, связанных с контролем без потери гарантий качества препарата. Большинство фармацевтических компаний уже пришли к пониманию того, что не все показатели качества и параметры процесса нужны и одинаково важны для получения убедительных доказательств качества выпускаемой продукции.
Современный подход, основанный на оценке рисков, заключается в том, чтобы на каждом этапе выбранной стратегии контроля (входной, межоперационный и приемочный контроль) обеспечивается контроль только критических параметров процесса и критических показателей качества продукта. Под критическим показателем качества продукта понимается физическое, химическое или биологическое свойство, выход которого за пределы установленной спецификации может привести к серьезным последствиям для потребителя. А под критическим параметром процесса понимается параметр, изменчивость (вариабельность) которого может привести к выходу критического параметра за пределы спецификации.
Другими словами, входной контроль проводится по тем показателям спецификации на сырье, которые важны для достижения качества готового продукта. Объем входного контроля (сплошной, выборочный) индивидуален, определяется степенью доверия к поставщику и основан на результатах аудита его производственной площадки. Межоперационный контроль также проводится только по показателям и параметрам, критичным для каждого отдельного продукта. При этом объем межоперационного контроля может быть значительно уменьшен по результатам валидации процессов и ежегодного обзора качества. Приемочный контроль частично (по отдельным показателям) основан на данных межоперационного контроля, частично на результатах лабораторного контроля контрольных образцов из серии. Процедура одобрения серии остается неизменной – серия может быть выпущена на рынок (отправлена потребителю) только после письменного разрешения Уполномоченного Лица на основании оценки досье серии и результатов аналитического контроля образцов готовой продукции.
В своем большинстве этот подход присущ современным фармацевтическим компаниям, которые стремятся работать на рынках различных стран. У отечественных производителей стран бывшего СССР развитие данного подхода ограничено. Во многом это вызвано двумя причинами. Первая – отсутствие достаточной компетентности у специалистов предприятий, и вторая, пожалуй основная, – «боязнь» регуляторных органов отпустить предприятия в свободное плавание, ослабить созданную и зацементированную десятилетиями систему тотального государственного контроля.
Инновационные подходы Большой Фармы
Фармацевтический рынок изменяется очень быстро. Инновационная компания тратит на разработку, исследования и регистрацию препарата в среднем около 1 млрд. долларов США. Все необходимые работы по внедрению нового продукта растягиваются на 10-15 лет. А срок патентной защиты у такого лекарства составляет 20 лет. Другими словами у производителя остается 5-10 лет на компенсацию всех своих затрат по препарату и получение «легкого» заработка. И понятно, что каждый час простоя, каждая минута решения вопроса о качестве сырья, полупродуктов и готовой продукции – это в среднем от 3000 до 20 000 долларов США. Учитывая все финансовые риски, мировые лидеры уже давно работают только с одобренными поставщиками, подтвердившими свою надежность безупречным партнёрством и качеством сырья. Мировые лидеры уже давно не допускают к самостоятельной работе необученных операторов. Цена ошибки такого оператора исчисляется миллионами, поэтому расходы в размере 2000-3000 долл. США на первичное и специальное обучение каждого новичка воспринимаются как желаемые предупреждающие затраты. Мировые лидеры уж давно работают на современном оборудовании, не экономя ресурсов на его обслуживание и замену. Именно поэтому традиционная ситуация с контролем качества уже давно не устраивает мировых лидеров. Тотальный входной контроль эффективен только при высокой доле брака в исходном сырье, выборочный межоперационный контроль – при слабых навыках операторов и плохом состоянии инфраструктуры (оборудование, инженерные системы и чистые помещения), а приемочный контроль на единичной выборке – по своей сути не информативен, ненадежен и неэффективен, если в ходе межоперационного контроля накапливается достаточный объем статистически обрабатываемых данных. Более того, полагаясь на тотальный контроль мы только ухудшаем ситуацию, делая фармацевтическое производство непрогнозируемым. Более того он не имеет смысла. Именно поэтому три кита нашего отечественного фармпрома, там у них за рубежом, рассматривается не как гарантия качества, а скорее как ограничение производственных возможностей и увеличение себестоимости и так не дешевых препаратов.
Понимая свою ответственность перед потребителем, принимая все возможные финансовые выгоды от использования современных знаний, инжиниринга и уровня развития компьютерной техники, мировые лидеры и ведущие регуляторные органы (ЕС, США), опираясь на существующие нормативные требования, на протяжении последних 2-х лет вводят новые концепции инновационного обеспечения качества при разработке, производстве и контроле качества ЛС.
В англоязычном пространстве эта концепция прочно закрепилась в документах ICH Q8, Q9, Q10 и Q11 под термином «Quality-by-Design, QbD». В русском языке специалистам еще придется найти подходящий термин. На сегодня есть два его наиболее широко употребляемые варианты – «Качество через разработку» и «Спланированное качество». Смысл такой концепции заключается в том, что качество программируется (закладывается, создается) на этапе разработки препарата. Все последующие этапы жизненного цикла (перенос технологии, валидация процессов, производство и продажи) должны поддерживать выбранную стратегию контроля и уточнять (при необходимости изменять) ее с учетом объема накапливаемых данных и выявляемых тенденций. Более того, не успев закрепиться в умах специалистов концепция QbD недавно получила свое развитие в виде процессно-аналитической технологии (Process Analytical Technology, РАТ), позволяющей организовать контроль в режиме реального времени.
На практике реализация инновационного подхода выглядит следующим образом:
- Изучение природы изменчивости (вариации), которая присуща создаваемому продукту;
- Определение критических показателей качества и критических параметров процесса;
- Определение характера взаимосвязи изменчивости критических параметров качества от изменчивости критических параметров процесса;
- Описание области проектных решений (Design Space);
- Формирование стратегии контроля качества;
- Автоматизация контроля;
- Организация выпуска по параметрам.
Изучение природы изменчивости (вариации), которая присуща создаваемому продукту
Первое – нужно представить для себя профиль целевого продукта. Другими словами необходимо ответить на вопросы:
- А что собственно мы хотим получить?
- Какими характеристиками это что-то должно обладать?
- Существуют ли какие-либо ограничения (нормативные требования, ожидания потребителей и т.п.)?
Второе – понять природу изменчивости. Другими словами ответить на вопросы:
- Что может в продукте изменяться?
- Что влияет на то, что может меняться?
- Что влияет на то, что влияет?
На этом этапе необходимо использовать знания по фармацевтической науке и опыт предприятия, включая ретроспективные данные по аналогичным препаратам. И так как на войне все средства хороши, хорошо помогает применение инструментов менеджмента качества.
Определение критических показателей качества и критических параметров процесса
Для выбора критических параметров качества и критических показателей процесса используется научное обоснование и методология оценки рисков. Это связано с тем, что между риском и критичностью есть прямая связь:
- Риск включает тяжесть вреда, вероятность развития и выявляемость (или степень ускользания от контроля). Таким образом управление риском может изменять уровень его критичности (неприемлемый, серьезный или незначительный).
- Критичность показателя качества (другими словами, критичность одного из свойств препарата) преимущественно основана на тяжести вреда и не изменяется в результате управления риском.
- Критичность параметра процесса связана с его воздействием на какой-либо критический показатель качества. Она основана на вероятности развития и выявляемости вреда и может изменяться в результате управления риском.
Соответственно еще на первичных этапах разработки мы с помощью методологии оценки рисков (выявляя вред, тяжесть его последствий и вероятность его возникновения) можем спрогнозировать критические показатели для продукта и критические параметры процесса. По мере получения новых знаний и экспериментальных данных на последующих этапах разработки, при переносе технологии и масштабировании производства, по результатам валидации наша оценка будет только уточняться.
Определение характера взаимосвязи изменчивости критических параметров качества от изменчивости критических параметров процесса
Существующие научные данные и результаты оценки рисков на этапе разработки препарата позволят составить план многофакторного эксперимента. Эксперимент, основанный на статистических принципах ортогональности, эталонного распределения и рандомизации, является эффективным способом выявления взаимодействий переменных процесса и продукта. Его результатом будут выявленные математические зависимости и модели типа y=f(x1,x2,…,xn) – где у – это критический показатель качества, а хi – критический i-й параметр процесса.
Описание области проектных решений (Design Space)
Область проектных решений – это комбинация одного или нескольких параметров процесса, влияющих на желаемое свойство продукта. По результатам многофакторного эксперимента устанавливаются допустимые диапазоны изменчивости каждого параметра процесса исходя из степени его влияния на ожидаемую спецификацию качества продукта.
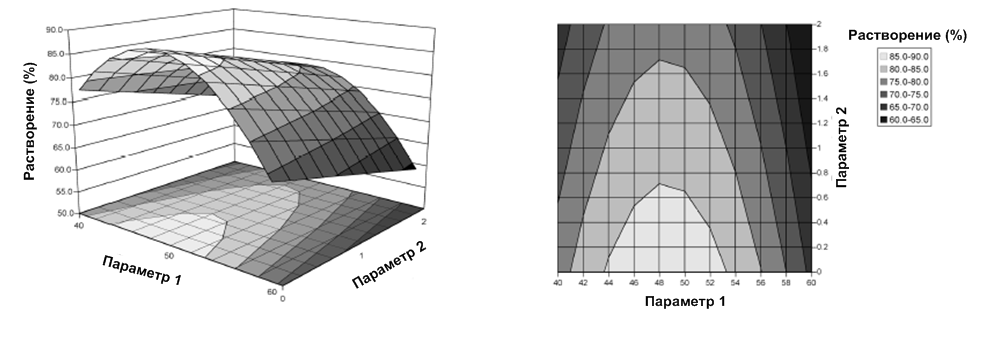
Область проектных решений выражается либо в виде упрощенной математической зависимости y=f(x1,x2,…,xn), или в виде диапазона параметров (для упрощения работы в производстве).
Формирование стратегии контроля качества
Стратегия контроля включает в себя критические параметры процесса и показатели качества продукта, с помощью которых моделируются последующие параметры процесса для получения продукта заданной спецификации. Другими словами – это тот же входной, межоперационный и приемочный контроль – только основанный на алгоритме, построенном на математических моделях зависимостей у=f(xi).
Зная природу изменчивости, зная степень влияния параметров процесса на показатели качества продукта при формировании стратегии не составит труда определить:
— Тип контроля (сплошной, выборочный);
— Точки отбора образцов (для обеспечения репрезентативности пробы);
— Необходимую точность испытаний;
— Возможность использования экспресс-методов;
— Возможности автоматизации.
Автоматизация контроля
Для проведения контроля нужны ресурсы. И прежде всего – это время и люди (персонал). Логика автоматизации контроля – это значительное сокращение времени контроля, исключение человеческого фактора и снижение стоимости контрольных операций.
Сокращение времени осуществляется за счет непрерывности контроля и отсутствия простоев в статусе «ожидает решения». Исключение человеческого фактора имеет неоспоримые преимущества. Во-первых, хороших аналитиков не так много, во-вторых стоят они недешево, и в третьих никто не застрахован от ошибочного результата контроля из-за рассеянности, вызванной плохим настроением, мигренью или просто задумчивостью аналитика.
Автоматизация контроля проводится в основном за счет оснащения производственного оборудования анализаторами процесса, осуществляющими преимущественно неразрушающие измерения критических показателей (свойств) продукта. Такие измерения могут проводиться:
i. В линии (in-line), когда проба не изымается из технологического потока;
ii. На линии (on-line), когда проба перенаправляется из потока на анализатор, и может потом возвращаться в процесс;
iii. Возле линии (at-line, когда проба изымается, выделяется и анализируется в непосредственной близости к технологическому потоку.
Анализаторы процесса (БИК-спектрометры, металлодетекторы, устройства динамического взвешивания и т.п.) обычно генерируют большой объем данных. С помощью таких данных и установленных математических зависимостей разрабатывается гибкий процесс, который учитывает вариабельность обрабатываемых материалов. При этом конечной точкой процесса является не точка во времени, а достижение желаемого свойства продукта (соответствие показателя заданной спецификации).
Валидация производственной системы
На этом этапе нам нужно показать, что удержание заданных параметров процесса, например температуры, расхода раствора увлажнителя при изготовлении таблеточной массы, дает нам и т.п.) позволяет нам получить например сыпучесть в некотором узком диапазоне, которая при соответствующих параметрах таблетирования (скорость и давление прессования) дает необходимую однородность массы таблеток. Результат валидации как правило представляется в виде статистических характеристик, например с помощью индексов возможностей процесса Сp ? Cpk ? 1.67.
Организация выпуска по параметрам
Выпуск по параметрам сопоставим с использованием альтернативных аналитических методов. Такой подход предполагает оценку качества готового продукта не на основании контроля образцов, отобранных из серии продукта, а на основании данных о производственном процессе, получаемых непрерывно на каждом из этапов производства. Концепция РАТ развивает практику, заявленную в Приложении 17 GMP по принятию решений о стерильности продукта исходя из параметров режима тепловой стерилизации (121 °С, не менее 15 мин.). Только теперь это становится применимо к любому показателю качества препарата при надлежащем обосновании.
И самое главное, меняется роль Уполномоченного Лица. Теперь его функция не столько принятие решения о возможности выпуска серии на рынок по принципу «контроль на конце трубы», сколько «создание этой самой трубы», устанавливающей правила поведения производственного процесса для достижения качества продукта.
Заключение
Подведем черту. Основная логика Большой Фармы в следующем:
— Входной лабораторный контроль неэффективен,
— Приемочный контроль излишен при управляемом производственном процессе,
— Межоперационный контроль будет эффективен только тогда, когда мы знаем что?, где? и когда? мы делаем.
Сами по себе концепции QbD и РАТ не считаются сложными, но их реализация требует глубоких знаний и серьезной доказательной базы, основанной на многократных экспериментальных данных.
Справедливости ради, хотелось бы вспомнить слова Эдварда Деминга из его книги «Out of Crisis»: «Зависимость от проверки напоминает лечение симптомов, в то время как болезнь убивает человека. Необходимость в проверке возникает в результате излишней изменчивости процесса. Изменчивость – это и есть болезнь. Устранение зависимости от проверок означает, что вы должны понимать и знать свои процессы настолько хорошо, чтобы предугадывать качество выпущенной продукции на основе последовательных видов деятельности и измерений. Чтобы справиться с этой задачей, необходимо иметь полное представление об источниках изменчивости в ваших процессах, и работать над снижением этой изменчивости. Устранение зависимости от проверок заставит вас снизить уровень самой изменчивости»
Фармацевтический рынок растет, показывая очень хорошую динамику развития. И если наши (отечественные) производители и регуляторные органы в ближайшее время не возьмут на вооружение подходы лидеров мирового рынка, мы на долгие годы неизбежно отстанем в знаниях и инновациях. Соответственно мы никогда не сможем составить конкуренции мировому фармацевтическому сообществу. И не столько по качеству (которое мы обязаны обеспечить независимо от подходов и затраченных ресурсов), сколько по эффективности организации производства лекарственных средств.
А так этого хочется, дерзайте!
Александр В. Александров,
президент группы компаний ВИАЛЕК,
Исполнительный директор Международной Фармацевтической Ассоциации Уполномоченных Лиц,
аудитор систем управления Европейской Организации Качества (EOQ)







