В данном обзоре собрана последняя информация, связанная с инспектированием производителей лекарственных средств для ветеринарного применения, производство которых осуществляется за пределами Российской Федерации, на соответствие требованиям Правил надлежащей производственной практики (Good Manufacturing Practice, GMP). Эти инспекции проводятся специалистами подведомственного Россельхознадзору Федерального государственного бюджетного учреждения «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГБУ «ВГНКИ»).

Правила GMP
С января 2021 года в отношении лекарственных средств для ветеринарного применения вступили в силу Правила GMP Евразийского экономического союза (Правила GMP ЕАЭС), утвержденные Решением Совета ЕЭК от 03.11.2016 № 77 [1].
В январе 2021 года на официальном интернет-портале правовой информации publication.pravo.gov.ru был опубликован Приказ Россельхознадзора от 17.11.2020 № 1231 «О внесении изменений в приказ Россельхознадзора от 18 октября 2016 г. № 755 «Об утверждении формы заявления о выдаче заключения о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики, формы инспекционного отчета по результатам инспектирования производителя (иностранного производителя) лекарственных средств для ветеринарного применения на соответствие требованиям правил надлежащей производственной практики и формы заключения о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики» [2].
Утвержденным документом внесены изменения в форму инспекционного отчета и в форму заключения о соответствии производителя лекарственных средств для ветеринарного применения требованиям Правил GMP. В частности, в форме заключения слова «Правил надлежащей производственной практики, утвержденных приказом Министерства промышленности и торговли Российской Федерации от 14 июня 2013 г. № 916» заменены словами «Правил надлежащей производственной практики Евразийского экономического союза, утвержденных решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 77» [3].
В мае 2021 года Коллегия ЕЭК одобрила проект Решения Совета ЕЭК о внесении изменений в Правила GMP ЕАЭС [4].
Согласно представленному документу, Приложение № 15 к Правилам GMP ЕАЭС «Квалификация и валидация» изложено уже в новой редакции. Решение вступит в силу по истечении 6 месяцев с даты его официального опубликования [5].
Приложением устанавливаются новые, значительно расширенные подходы к валидации и квалификации производственных процессов. Впервые вводятся указания на возможность замены валидации непрерывной верификацией процесса производства, продолжающейся верификацией процесса производства либо верификацией (валидацией) отдельных стадий. Также производители смогут использовать гибридный подход к валидации процесса производства. В результате изменений Правила GMP ЕАЭС будут синхронизированы с действующей европейской редакцией [6].
Дополнительно, о переходе производителей ветеринарных препаратов на Правила GMP ЕАЭС можно прочитать здесь: http://www.spzoo.ru/cntnt/default/n6439.html
Правила организации и проведения инспектирования
В апреле 2021 года ЕЭК разъяснила, что положения актов Комиссии, касающиеся порядка и процедуры проведения фармацевтических инспекций (Решения Совета ЕЭК от 3 ноября 2016 г. № 82, 83, 90, 91), не содержат соответствующего уточнения по сфере применения для ветеринарных лекарственных средств и, следовательно, не распространяются на их обращение. Учитывая, что разработанный Комиссией проект Правил, которым предусмотрен порядок и процедура проведения фармацевтических инспекций производства ветеринарных лекарственных средств, до настоящего времени не принят Комиссией, контроль соблюдения требований Правил GMP ЕАЭС при производстве ветеринарных лекарственных средств в государствах — членах Союза осуществляется в порядке, установленном законодательством соответствующего государства — члена Союза.
Таким образом, в отношении лекарственных средств для ветеринарного применения действуют только «Правила организации и проведения инспектирования производителей лекарственных средств на соответствие требованиям правил надлежащей производственной практики, а также выдачи заключений о соответствии производителя лекарственных средств указанным требованиям», утвержденные Постановлением Правительства Российской Федерации от 03.12.2015 № 1314 «Об определении соответствия производителей лекарственных средств требованиям правил надлежащей производственной практики» [7].
Результаты инспектирования
В июне 2021 года в рамках деловой программы выставки «МVC: Зерно-Комбикорма-Ветеринария-2021» состоялась конференция «Актуальные вопросы обращения лекарственных средств для ветеринарного применения, профилактики и лечения инфекционных болезней продуктивных животных». На этой конференции, заместитель директора, руководитель Органа инспекции ФГБУ «ВГНКИ» Данил Рудняев представил доклад «Четыре года инспектирования иностранных производителей лекарственных средств для ветеринарного применения. Опыт и перспективы». Комментируя результаты инспектирования иностранных производителей в 2021 году, он отметил, что в связи с продолжающейся пандемией проведение выездных инспекций затруднено и очередь из желающих площадок продолжает расти. На сегодняшний момент удалось провести 14 инспекций, из которых только 4 осуществлены с выездом на производственную площадку [8].
В соответствии с графиком проведения инспектирования, опубликованном на сайте ФГБУ «ВГНКИ» 05.07.2021 г., на вторую половину 2021 года и на первый квартал 2022 года запланировано уже 50 инспекций производителей ветеринарных препаратов, площадки которых расположены в Австралии, Беларуси, Бельгии, Болгарии, Бразилии, Венгрии, Вьетнаме, Германии, Египте, Испании, Италии, Китае, Корее, Нидерландах, Словении, США, Турции, Уругвае, Финляндии, Франции, Чехии и Швейцарии [9].
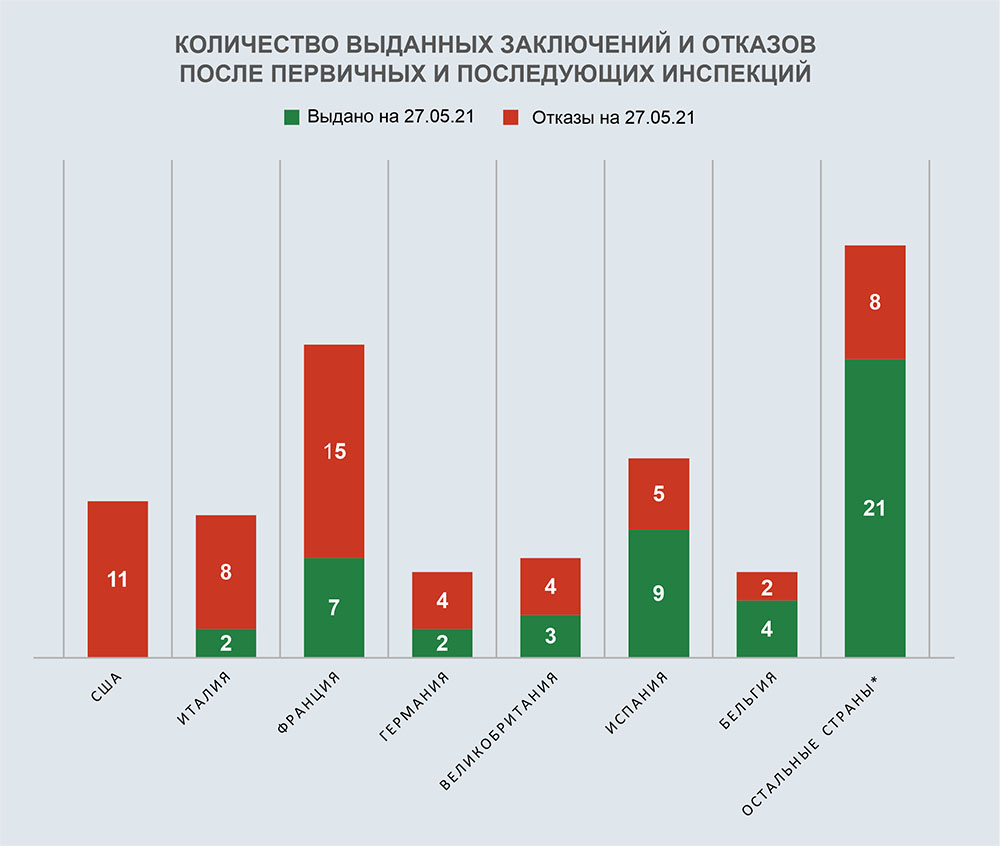
Согласно реестру выданных заключений, опубликованному на сайте Россельхознадзора 27.05.2021 г., в 2021 году уже было выдано 5 заключений о соответствии иностранных производителей требованиям Правил GMP [10].
Два из этих заключений были сделаны в отношении площадки, расположенной во Франции, а три другие — в отношении площадок, расположенных в Бельгии, Израиле и Португалии.
Информация о французских производителях ветеринарных препаратов и их инспектировании на соответствие требованиям Правил GMP представлена здесь: https://inpharmation.ru/francuzskie-proizvoditeli-veterinarnyx-preparatov-i-ix-inspektirovanie/
Инспектирование в дистанционном формате
В соответствии с п.7(1). Постановления Правительства Российской Федерации от 03.12.2015 № 1314, в условиях угрозы возникновения, возникновения и ликвидации чрезвычайной ситуации и (или) при возникновении угрозы распространения заболевания, представляющего опасность для окружающих, заболеваний и поражений, полученных в результате воздействия неблагоприятных химических, биологических, радиационных факторов, при которых проведение инспектирования производителя, предусматривающего осмотр производственной площадки, не представляется возможным, заключение выдается на срок 3 года, который исчисляется со дня окончания проведения инспектирования производственной площадки по документам, в том числе с использованием средств дистанционного взаимодействия, включая аудио- или видеосвязь [7].
Выступая на конференции в рамках выставки «МVC: Зерно-Комбикорма-Ветеринария-2021», Данил Рудняев рассказал о том, что всего от иностранных производителей ветеринарных препаратов в Россельхознадзор поступило 41 обращение на проведение дистанционных инспекций, и в отношении 20 из них было принято положительное решение (на сегодняшний день 19 инспекций в дистанционном формате уже проведено и одна инспекция запланирована на середину июля). Представляя результаты инспектирования иностранных производителей за прошлый год, он отметил падение количества проведенных инспекций, так как из-за пандемии выезд инспекторов на многие площадки не состоялся. При этом Данил Рудняев обратил внимание на то, что провести инспектирование высокотехнологических предприятий, особенно тех, которые производят иммунобиологическую продукцию, в дистанционном формате невозможно [8].
Некоторые рекомендации по подготовке к дистанционному инспектированию производителей лекарственных средств на соответствие требованиям Правил GMP можно найти здесь: https://inpharmation.ru/podgotovka-k-distancionnomu-gmp-inspektirovaniyu/
Корректирующие и предупреждающие действия (САРА) по результатам инспектирования
В соответствии с п. 27. Постановления Правительства Российской Федерации от 03.12.2015 № 1314, иностранный производитель или его уполномоченный представитель в срок не позднее 60 рабочих дней со дня получения им инспекционного отчета (без заполнения раздела, содержащего заключительные рекомендации и выводы) вправе представить в уполномоченное учреждение письмо с приложением плана CAPA и копий документов, оформленных в установленном порядке, содержащих мероприятия по его выполнению, а также документа, подтверждающего оплату дополнительных услуг по инспектированию [7].
В июне 2021 года на сайте Россельхознадзора в разделе «Инспектирование. Выдача заключения» была размещена новая «Форма заполнения плана корректирующих и предупреждающих действий по устранению несоответствий, выявленных в ходе инспектирования» [11].
Часто повторяющиеся несоответствия
В мае 2021 года в Суздале состоялась конференция на тему «Фармацевтическая система качества. Актуальные вопросы обеспечения качества лекарственных средств». Данное мероприятие прошло в рамках третьего дня отраслевого пресс-тура III Всероссийского Фармпробега. Выступая на этой конференции, Данил Рудняев отметил, что первое, с чем столкнулись инспектора, когда начали осуществлять инспектирование производителей лекарственных средств для ветеринарного применения — это большое количество несоответствий, связанных с расхождением информации в регистрационном досье и фактическим состоянием дел на площадке. Например, методы контроля, которые были прописаны в регистрационном досье, не соответствовали методам контроля, используемым на предприятии [12].
На конференции в рамках выставки «МVC: Зерно-Комбикорма-Ветеринария-2021», Данил Рудняев представил перечень часто повторяющихся несоответствий при инспектировании производителей ветеринарных препаратов:
- не осуществляется контроль изменений (не проводится оценка эффективности изменений, внесенных в производственный процесс);
- не осуществляется входной контроль материалов первичной упаковки на микробиологическую чистоту (в частности, для нестерильных препаратов);
- образцы для испытаний не являются репрезентативными для серии материала или готовой продукции, из которой они отбираются (используются инструменты, с помощью которых не представляется возможным отобрать представительную выборку из емкостей сырья большого объема);
- квалификация складских помещений проводится без учета риска колебаний температуры при смене сезонов (испытания не проводятся в самый жаркий и самый холодный период времени года для конкретного региона);
- методики контроля качества, используемые на предприятии, не валидированы (методы не валидированы для конкретного помещения и конкретного оборудования площадки);
- этапы квалификации функционирования или эксплуатации помещений, систем и оборудования не включает необходимые элементы (IQ, OQ, PQ);
- при валидации процессов не проводятся испытания при рабочих параметрах, равных верхним и нижним допустимым пределам;
- валидация процесса (в том числе очистки) проводится не на 3-х последовательных сериях (циклах), при которых параметры находятся в заданных пределах;
- не определяются интервалы времени между окончанием процесса и очисткой, между очисткой и началом следующего процесса (то же самое при стерилизации);
- не проводится контроль целостности флаконов со стерильной продукцией (не проводится контроль с периодичностью, определенной с учетом анализа рисков);
- первичные упаковки с продукцией для парентерального введения не проверяются на наличие посторонних включений (не осуществляется 100%-й контроль всех единиц) [8].
Согласование сроков по устранению критических несоответствий
В мае 2021 года на официальном интернет-портале правовой информации publication.pravo.gov.ru был опубликован Приказ Россельхознадзора от 22.03.2021 № 282 «Об установлении Порядка приостановления реализации и применения лекарственных препаратов для ветеринарного применения» [13].
Согласно утвержденному документу, одним из оснований для рассмотрения Россельхознадзором вопроса о приостановлении реализации и применения лекарственного препарата для ветеринарного применения является следующий случай: производителем лекарственных средств в согласованный с Россельхознадзором срок не устранены нарушения требований Правил GMP, которые были выявлены в ходе проведения инспектирования производителя лекарственных средств и привели или могут привести к производству лекарственных препаратов, причинивших или способных причинить вред жизни или здоровью животных [14].
В июне 2021 года, в целях обсуждения вопросов, связанных с вступлением в силу Приказа Россельхознадзора от 22.03.2021 № 282, Управление внутреннего ветеринарного надзора Россельхознадзора провело видеоконференцию с участием представителей ветеринарного и фармацевтического бизнес-сообществ. По результатам договоренностей, достигнутых на этом совещании, на сайте Россельхознадзора в разделе «Фармаконадзор» были размещены «Рекомендации по согласованию с Россельхознадзором плана корректирующих и предупреждающих действий по устранению несоответствий, выявленных при проведении инспектирования. Форма заполнения плана корректирующих и предупреждающих действий по устранению несоответствий, выявленных в ходе инспектирования» [15].
GMP-заключение при вводе препаратов в гражданский оборот
В июне 2021 года на пленарном заседании Государственной Думы Федерального Собрания Российской Федерации был принят в третьем чтении законопроект «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» в части ввода в гражданский оборот лекарственных препаратов для ветеринарного применения». Принятый Федеральный закон от 02.07.2021 № 317-ФЗ опубликован на официальном интернет-портале правовой информации publication.pravo.gov.ru [16].
Законом предусмотрено, что ввод в гражданский оборот ввозимого (перемещаемого) в Российскую Федерацию лекарственного препарата для ветеринарного применения осуществляется при наличии заключения о соответствии производителя лекарственных средств требованиям Правил GMP, выданного уполномоченным федеральным органом исполнительной власти для производственной площадки лекарственного препарата для ветеринарного применения, вводимого в гражданский оборот. Федеральный закон вступит в силу с 1 сентября 2023 года [17].
Обучение
В апреле 2021 года в Торгово-промышленной палате Российской Федерации состоялось торжественное открытие Евразийской Академии надлежащих практик, где будут обучаться как фармацевтические инспектораты разных стран, так и профильные отраслевые представители. В церемонии открытия приняли участие первые лица профильных министерств и ведомств государств — членов ЕАЭС, ЕЭК, представители регуляторных органов союзных государств, отраслевых сообществ и ассоциаций, а также руководители фармацевтических предприятий. Академия является дочерней структурой Федерального бюджетного учреждения «Государственный институт лекарственных средств и надлежащих практик» (ФБУ «ГИЛС и НП»). [18].
Выступая на церемонии открытия, директор ФГБУ «ВГНКИ» Леонид Киш отметил, что создание Академии надлежащих практик — это серьезное событие не только в области повышения квалификации фармацевтических инспекторов, но и в вопросах подготовки новых высококвалифицированных специалистов фармацевтической отрасли [19].
На конференции в рамках III Всероссийского Фармпробега, заместитель директора ФГБУ «ВГНКИ» Василина Грицюк обратила особое внимание на то, что даже если есть определенный набор знаний, крайне важно постоянно совершенствоваться и повышать квалификацию [12].
В 2021 году в ФГБУ «ВГНКИ» продолжается проведение обучающих мероприятий для специалистов предприятий-производителей лекарственных средств для ветеринарного применения [20].
В первой половине 2021 года в рамках совместной программы содействия внедрению лучших образцов надлежащих практик в российской фармацевтической отрасли — проекта «СОЛИДАРНАЯ ПРОГРАММА ОБУЧЕНИЯ», было проведено больше 20 корпоративных семинара для компаний, реализующих «политику открытых дверей». Инициатором проекта выступили компания «ФАРМСТРАТЕГИЯ» и ФБУ «ГИЛС и НП» [21].
В июне 2021 года открылась регистрация на VI Всероссийскую GMP-конференцию с международным участием, которая состоится в Санкт-Петербурге 22-24 сентября. Организатором конференции выступает Министерство промышленности и торговли Российской Федерации совместно с ФБУ «ГИЛС и НП». 23 сентября в рамках конференции состоится панельная дискуссия «Инспектирование производителей лекарственных препаратов для ветеринарного применения. Регулирование и статистика. Взгляд государства и бизнеса». Среди вопросов, запланированных к обсуждению: регулирование инспектирования производителей ветеринарных препаратов по правилам ЕАЭС; опыт инспектирования европейских производителей ветеринарных препаратов. Среди спикеров, которые планируют выступить — представители ФГБУ «ВГНКИ», Минсельхоза России, Россельхознадзора, ЕЭК, производителей препаратов для ветеринарного применения [22].
Производителям ветеринарных препаратов рекомендуется принимать активное участие в обучающих мероприятиях и тщательнее готовиться к GMP-инспектированию.
Представленный материал подготовлен с использованием данных, актуальных на 21.07.2021.
В случае получения новых или дополнительных данных, статья может быть обновлена.
Ссылки:
- Евразийский экономический союз / Решение Совета Евразийской экономической комиссии от 03.11.2016 г. № 77 «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза». URL: https://docs.eaeunion.org/docs/ru-ru/01411921/cncd_21112016_77 (дата обращения 07.2021)
- Официальный интернет-портал правовой информации / Приказ Федеральной службы по ветеринарному и фитосанитарному надзору от 17.11.2020 № 1231 «О внесении изменений в приказ Россельхознадзора от 18 октября 2016 г. № 755 «Об утверждении формы заявления о выдаче заключения о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики, формы инспекционного отчета по результатам инспектирования производителя (иностранного производителя) лекарственных средств для ветеринарного применения на соответствие требованиям правил надлежащей производственной практики и формы заключения о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики». URL: http://publication.pravo.gov.ru/Document/View/0001202101180011 (дата обращения 15.07.2021)
- ФармПром.РФ / Новости / Изменились формы инспекционных отчетов и заключений по GMP для ветпроизводителей. URL: https://pharmprom.ru/izmenilis-formy-inspekcionnyx-otchetov-i-zaklyuchenij-po-gmp-dlya-vetproizvoditelej/ (дата обращения 15.07.2021)
- Евразийский экономический союз / Распоряжение Коллегии Евразийской экономической комиссии от 19.05.2021 г. № 77 «О проекте Решения Совета Евразийской экономической комиссии «О внесении изменений в Правила надлежащей производственной практики Евразийского экономического союза». URL: https://docs.eaeunion.org/docs/ru-ru/01429302/err_24052021_77 (дата обращения 15.07.2021)
- ФармПром.РФ / Новости / В Правилах GMP ЕАЭС изменятся требования к квалификации и валидации. URL: https://pharmprom.ru/v-pravilax-gmp-eaes-izmenyatsya-trebovaniya-k-kvalifikacii-i-validacii/ (дата обращения 15.07.2021)
- Евразийский экономический союз / Новости / Расширены возможности производителей лекарств по проведению валидации и квалификации производств в системе GMP. URL: https://eec.eaeunion.org/news/rasshireny-vozmozhnosti-proizvoditelej-lekarstv-po-provedeniyu-validatsii-i-kvalifikatsii-proizvodstv-v-sisteme-gmp/ (дата обращения 15.07.2021)
- ФГБУ «ВГНКИ» / Структура / Отдел инспекции производства на соответствие требованиям надлежащей производственной практики / Нормативно-правовая документация. URL: http://www.vgnki.ru/assets/files/post-1314.pdf (дата обращения 15.07.2021)
- ФармПром.РФ / Статьи / Четыре года инспектирования иностранных ветпроизводителей: опыт и перспективы. URL: https://pharmprom.ru/chetyre-goda-inspektirovaniya-inostrannyx-vetproizvoditelej-opyt-i-perspektivy-2/ (дата обращения 15.07.2021)
- ФГБУ «ВГНКИ» / Структура / Отдел инспекции производства на соответствие требованиям надлежащей производственной практики / График проведения инспектирования иностранных производителей на соответствие требованиям надлежащей производственной практики. URL: http://www.vgnki.ru/assets/files/grafik-na-sajt- pdf (дата обращения 05.07.2021)
- Россельхознадзор / Регистрация и лицензирование / Инспектирование. Выдача заключения / Реестр заключений о соответствии производителя требованиям правил надлежащей производственной практики. URL: https://fsvps.ru/fsvps/regLicensing/conclusion/conclusionReestr.html (дата обращения 15.07.2021)
- Россельхознадзор / Регистрация и лицензирование / Инспектирование. Выдача заключения / Форма заполнения плана корректирующих и предупреждающих действий по устранению несоответствий, выявленных в ходе инспектирования. URL: https://fsvps.gov.ru/fsvps/regLicensing/conclusion (дата обращения 07.2021)
- Фармпробег / Новости / Фармпробег-2021 в Суздале поднял тему фармацевтической системы качества. URL: https://pharmprobeg.ru/novosti/farmprobeg-2021-v-suzdale-podnyal-temu-farmatsevticheskoj-sistemy-kachestva/ (дата обращения 15.07.2021)
- Официальный интернет-портал правовой информации / Приказ Федеральной службы по ветеринарному и фитосанитарному надзору от 22.03.2021 № 282 «Об установлении Порядка приостановления реализации и применения лекарственных препаратов для ветеринарного применения». URL: http://publication.pravo.gov.ru/Document/View/0001202105200021 (дата обращения 15.07.2021)
- ФармПром.РФ / Новости / Утверждён порядок приостановки реализации и применения ветеринарных препаратов. URL: https://pharmprom.ru/utverzhdyon-poryadok-priostanovki-realizacii-i-primeneniya-veterinarnyx-preparatov/ (дата обращения 15.07.2021)
- Россельхознадзор / Регистрация и лицензирование / Фармаконадзор / Рекомендации по согласованию с Россельхознадзором сроков по устранению несоответствий, выявленных при проведении инспектирования/лицензионного контроля. Форма заполнения плана корректирующих и предупреждающих действий по устранению несоответствий, выявленных в ходе инспектирования/лицензионного контроля. URL: https://fsvps.gov.ru/fsvps/regLicensing/farmakonadzor.html (дата обращения 15.07.2021)
- Официальный интернет-портал правовой информации / Федеральный закон от 02.07.2021 № 317-ФЗ «О внесении изменений в Федеральный закон «Об обращении лекарственных средств». URL: http://publication.pravo.gov.ru/Document/View/0001202107020024 (дата обращения 15.07.2021)
- ФармПром.РФ / Новости / Закон о вводе в оборот ветеринарных препаратов принят Госдумой. URL: https://pharmprom.ru/zakon-o-vvode-v-oborot-veterinarnyx-preparatov-prinyat-gosdumoj/ (дата обращения 15.07.2021)
- Евразийская Академия надлежащих практик / Новости / Открытие GxP Академии объединило регуляторов стран ЕАЭС. URL: https://gxp-academy.org/news/otkrytie-gxp-akademii-obedinilo-regulyatorov-stran-eaes/ (дата обращения 15.07.2021)
- ФГБУ «ВГНКИ» / Пресс-центр / Новости / Директор ФГБУ «ВГНКИ» Леонид Киш принял участие в открытии Евразийской Академии надлежащих практик. URL: http://www.vgnki.ru/direktor-fgbu-vgnki-leonid-kish-prinyal-uchastie-v-otkrytii-evrazijskoj-akademii-nadlezhashhih-praktik.html (дата обращения 15.07.2021)
- ФГБУ «ВГНКИ» / Образование / Дополнительное профессиональное образование / Планы мероприятий / План обучающих мероприятий для специалистов предприятий-производителей лекарственных средств для ветеринарного применения на 2021 год. URL: http://www.vgnki.ru/assets/files/plan-2021-itog_proizvoditeli.pdf (дата обращения 15.07.2021)
- Совместная программа содействия внедрению лучших образцов надлежащих практик в российской фармацевтической отрасли / Отчеты / Календарно-тематический план «Солидарной программы обучения» (январь-июнь 2021 г.). URL: https://www.goodpractices.ru/upload/iblock/ca6/SP-i-SORpdf (дата обращения 15.07.2021)
- VI Всероссийская GMP-конференция с международным участием. URL: http://gosgmp.ru/ (дата обращения 21.07.2021)