
Константин Морозов, специалист по GMP, аудитор фармацевтических предприятий
В первой и второй частях данной статьи были приведены ответы на некоторые общие вопросы, которые касаются упаковки лекарственных препаратов в соответствии с требованиями Правил надлежащей производственной практики (Good Manufacturing Practice, GMP). В этой части статьи мы отдельно поговорим об упаковке, маркировке, хранении и транспортировке лекарственных препаратов для животных.
Требования Правил GMP ЕС [1], как и Правил GMP ЕС ЕАЭС [2] к производству ветеринарных лекарственных средств являются такими же, как и при производстве лекарственных средств для медицинского применения. Некоторые подробные требования Правил изложены в Приложениях 4 [3] и 5 [4], специфичных для ветеринарных лекарственных препаратов и для иммунобиологических ветеринарных лекарственных препаратов. Про упаковку в этих Приложениях написано мало.
В 2021 году на сайте Европейского агентства лекарственных средств (ЕМА) появились два документа: EMA/628488/2021 «Концептуальный документ по пересмотру Приложения 4 к руководству по GMP — производство ветеринарных препаратов, кроме иммунобиологических препаратов» (Concept paper on the revision of Annex 4 of the guidelines on Good Manufacturing Practice — Manufacture of veterinary medicinal products other than immunologicals) [5] и EMA/628491/2021 «Концептуальный документ по пересмотру Приложения 5 к руководству по GMP для лекарственных средств — производство иммунобиологических ветеринарных препаратов» (Concept paper on the revision of Annex 5 of the guidelines on Good Manufacturing Practice for medicinal products — Manufacture of immunological veterinary medicinal products) [6]. Основания для пересмотра этих Приложений похожие. Оба они не пересматривалась с момента их первоначального выпуска в 1992 году. В частности, они не отражают достижения в производстве и разработке новых лекарственных форм; пересмотренный текст будет охватывать применение новых технологий, которые были разработаны после публикации первоначальных Приложений и поэтому в настоящее время в них не рассматриваются. Например, Приложение 4 [3] не охватывает требования к продуктам, производство которых имеет специфические «ветеринарные» проблемы (такие как упаковки большого объема/веса и т. д.). Возможно, обновленные Приложения будут содержать больше требований и разъяснений в том числе в области упаковки. В ряде случаев упаковка ветеринарных препаратов сталкивается с большими вызовами, поскольку отрасль охватывает широкий спектр видов и пород животных. При этом все ветеринарные препараты — от пероральных средств до средств местного применения от инфекций и блох — должны быть упакованы так, чтобы обеспечить максимальную защиту и барьерные свойства.
Упаковочные материалы для ветеринарных препаратов
Чтобы гарантировать эффективность продукции в течение всего срока ее годности, фармацевтические препараты следует рассматривать как комбинацию самого лекарственного средства и упаковки. Плохая упаковка, являющаяся результатом недостатков системы обеспечения качества упаковки, может иметь серьезные последствия, а дефекты упаковки могут создать проблемы, которые могут привести к отзыву продукции.
Интересная таблица представлена в учебном пособии «Рациональное использование ветеринарных препаратов и вакцин» («Rational use of veterinary drugs and vaccines» training manual) [7], подготовленном совместной группой из представителей Управления по контролю за ветеринарными препаратами и кормами (VDFACA) Эфиопии и факультета ветеринарной медицины Гондарского университета.
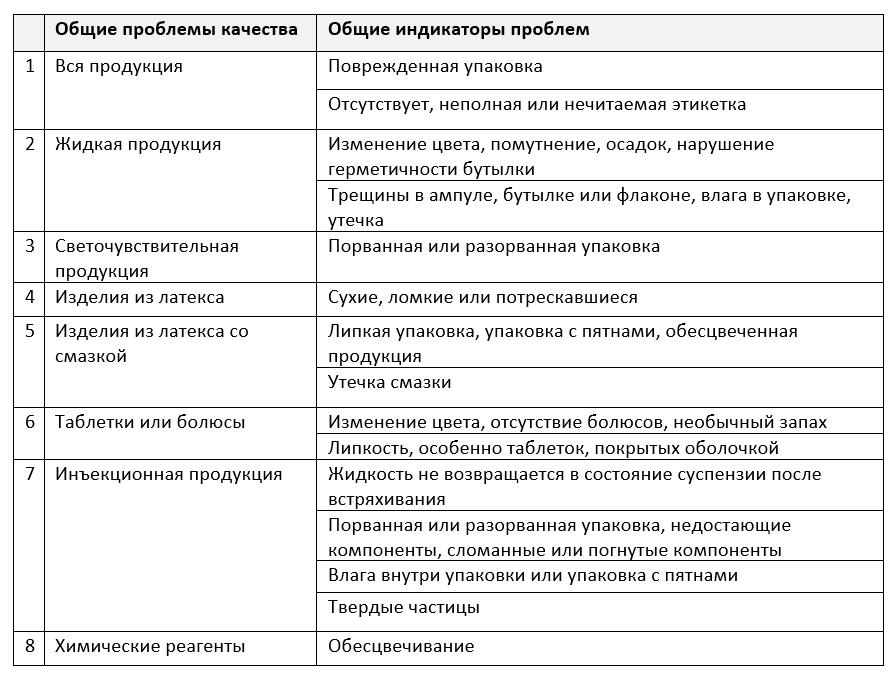
Из этой таблицы видно, что качество упаковочных материалов играет очень важную роль для качества ветеринарной фармацевтической продукции.
Поскольку ветеринарная фармацевтика предлагает огромный выбор продуктов, упаковка может стать важным аргументом для потребителей. Производители упаковочных материалов и консалтинговые компании советуют заранее учитывать все задачи, которые должна решать первичная и вторичная упаковка, такие как:
- защита от света, повышенной влажности/сухости/температуры, сдавливания, механического удара и повреждений при обращении;
- простота применения;
- защита от детей.
Производители товаров для здоровья животных считают удобство применения продукта очень важным фактором. Например, чем легче ветеринару вводить препарат, учитывая его упаковку, тем больше вероятность, что ветеринар продолжит использовать этот препарат [8, 9].Некоторые интересные виды упаковки ветеринарных препаратов мы рассмотрим далее.
Ветеринарные препараты, хранящиеся в сосудах Дьюара
В настоящее время большинство вакцин для домашней птицы применяется в инкубаториях. Многие из них, такие как вакцина против болезни Марека или векторные вакцины HVT, для сохранения целостности хранятся в сосуде Дьюара с жидким азотом при температуре -196˚C.
Процесс поддержки эффективной транспортировки и хранения замороженных вакцин является сложной задачей. Должен существовать безупречный протокол холодовой цепи, включающий все материалы, оборудование и процедуры, чтобы гарантировать замораживание с момента производства до момента введения вакцины. Жидкий азот необходим для поддержания живых клеток в вакцине.
Авторы статьи «Обеспечение целостности замороженной вакцины и безопасности оператора» (Mastering frozen vaccine integrity and operator safety) делятся своей передовой практикой, применяемой на каждом этапе дистрибьюции. Среди прочего они рассказывают о следующих мерах, направленных на сохранение целостности вакцины [10]:
- любое воздействие комнатной температуры сведено к минимуму, а условия хранения вакцин регулярно контролируются на производственном предприятии, складе и в инкубаторе;
- особое внимание вакцине уделяется на складе при необходимости ее извлечения из жидкого азота при приемке, при перекладке из одного контейнера в другой, при контроле запасов и при подготовке заказа;
- в инкубатории клиентов обучают и поощряют уделять особое внимание приемке, контролю запасов и приготовлению вакцин; после каждого из этих действий контролируют и фиксируют уровень жидкого азота и соответствие ампул в перевернутом положении;
- сосуды Дьюара получают исключительный уход на всех этапах благодаря постоянному визуальному контролю, проверке жизнеспособности и цифровому отслеживанию.
Что же представляет собой сосуд Дьюара — специализированный контейнер с жидким азотом, который применяется в том числе для транспортировки и хранения замороженных вакцин?
Изначально сосуд Дьюара был изобретен для сохранения газов в жидком состоянии, но нашел применение в ветеринарии и медицине. К его составным частям относятся внутренний и внешний сосуды из алюминия или нержавеющей стали, соединяющая их горловина, крышка и пробка, ручки. Это резервуар типа «сосуд в сосуде», межстенное пространство которого заполнено многослойной изоляцией, позволяющей свести к минимуму испарение жидкого азота из-за теплопритоков при температуре -196°С. Снаружи внутренний сосуд покрыт специальным впитывающим материалом, который при охлаждении поглощает остаточные газы из вакуумной полости. Ампулы с вакциной находятся во внутреннем сосуде, закрепленными в специальных металлических фиксаторах — криотростинах/криосоломинах (cryo canes).
Несмотря на то, что Приложение 2 к Правилам GMP EC [11]/Правилам GMP ЕАЭС [2] относится к производству биологических (в том числе иммунобиологических) активных фармацевтических субстанций и лекарственных препаратов для медицинского применения, требование пункта 64. в этом Приложении может быть также актуально для ветеринарных препаратов, хранящихся в сосуде Дьюара с жидким азотом: в случае использования сверхнизких температур хранения устойчивость этикеток (в Правилах GMP ЕАЭС [2] — маркировки) к используемым температурам должна быть подтверждена. Если на ампулы с вакциной нанесены этикетки, то в течение всего срока хранения продукции они не должны отклеиваться от ампул.
На устойчивость этикеток к сверхнизким температурам следует обратить внимание при обсуждении вопросов маркировки лекарственных препаратов для ветеринарного применения средствами идентификации. В начале этого года на Федеральном портале проектов нормативных правовых актов regulation.gov.ru был опубликован проект постановления Правительства Российской Федерации «Об утверждении Правил маркировки лекарственных препаратов для ветеринарного применения средствами идентификации и особенностях внедрения государственной информационной системы мониторинга за оборотом товаров, подлежащих обязательной маркировке средствами идентификации, в отношении лекарственных препаратов для ветеринарного применения» [12]).
Вопрос о том, как будут маркироваться средствами идентификации ветеринарных препараты, хранящиеся в сосуде Дьюара, возникал еще в конце прошлого года. Об этом говорил председатель совета директоров НПП «АВИВАК» Иван Рождественский: «Например, скажите мне, куда наносить маркировку на вакцину против болезни Марека? Жидкую вакцину хранят только в сосудах Дьюара или биологических хранилищах (ампулы должны быть полностью погружены в жидкий азот). Маркировать сосуд Дьюара?» [13].
 Сосуд Дьюара не является потребительской упаковкой, в нем может храниться и транспортироваться нестандартное количество ампул. Маркировка средствами идентификации самих ампул является проблематичной (это первичные упаковки очень маленького размера, а размер DataMatrix кода должен позволять удобное его считывание). Маркировка средствами идентификации металлических фиксаторов может быть также непрактичной (в фиксаторе закреплена не одна, а несколько ампул, и фиксатор находится внутри сосуда с жидким азотом).
Сосуд Дьюара не является потребительской упаковкой, в нем может храниться и транспортироваться нестандартное количество ампул. Маркировка средствами идентификации самих ампул является проблематичной (это первичные упаковки очень маленького размера, а размер DataMatrix кода должен позволять удобное его считывание). Маркировка средствами идентификации металлических фиксаторов может быть также непрактичной (в фиксаторе закреплена не одна, а несколько ампул, и фиксатор находится внутри сосуда с жидким азотом).
Очевидно, что одним из решений может быть исключить из перечня лекарственных препаратов для ветеринарного применения, подлежащих обязательной маркировке средствами идентификации, те препараты, которые хранятся при сверхнизких температурах, если для них не будут предложены оптимальные варианты маркировки (в том числе посредством нанесения этикетки, содержащей средство идентификации) без нанесения вреда качеству этих препаратов.
Премиксы для лечебных кормов
В соответствии с Регламентом (ЕС) 2019/6 Европейского Парламента и Совета (Regulation (EU) 2019/6 of the European Parliament and of the Council) [14], премиксы для лечебных кормов считаются лекарственной формой ветеринарного лекарственного препарата до тех пор, пока упомянутые препараты не будут включены в лечебный корм или промежуточные продукты. В Приложении 4 к Правилам GMP ЕС [3] есть специальный раздел, где приведено определение премикса для лечебных кормов (pre-mix for medicated feeding stuffs) — это любой ветеринарный лекарственный препарат, заранее приготовленный с целью последующего производства лечебных кормов.
Безусловно, премикс для лечебных кормов — это весьма специфическая форма ветеринарного препарата, поэтому их рекомендуют производить на специально отведенных участках, которые не являются частью основного производственного предприятия, или рекомендуют окружать выделенные зоны буферной зоной, чтобы свести к минимуму риск контаминации других производственных зон.
Интересно, что в Малайзии есть отдельные требования GMP для ветеринарных премиксов — «Руководство по надлежащей производственной практике (GMP) для ветеринарных премиксов» (Guideline on Good Manufacturing Practice (GMP) for Veterinary Premixes) [15]. В этом руководстве уделяется достаточно много внимания упаковке и упаковочным материалам. В частности, системы разгрузки и упаковки, включая все стационарные или мобильные силосы, контейнеры и резервуары, должны быть спроектированы и эксплуатироваться таким образом, чтобы предотвратить контаминацию, непреднамеренное смешивание или ошибочную идентификацию готового продукта. Ключевые элементы этой системы заключаются в том, что:
- контейнеры (силосы, резервуары и т. д.) должны быть идентифицированы соответствующей маркировкой или системой нумерации;
- продукт, хранящийся в определенном контейнере (силосе, резервуаре и т. д.), должен быть идентифицирован с помощью документации и записей;
- контейнеры (силосы, резервуары и т. д.) должны быть спроектированы так, чтобы они могли свободно опорожняться, легко контролироваться и очищаться, а также быть закрытыми и защищенными.
Когда мы говорим о необходимости снижения риска контаминации продукции, нужно помнить и о материалах первичной упаковки. Эти материалы должны быть разработаны, произведены и обработаны таким образом, чтобы не оказывать негативного влияния на безопасность, идентичность, качество и чистоту лекарственного препарата. Контролю первичных упаковочных материалов следует уделять такое же внимание, как и исходным материалам. Материалы первичной упаковки должны быть чистыми до начала операции наполнения.
Какие требования к микробиологической чистоте могут предъявляться к материалам первичной упаковки премиксов для лечебных кормов — нестерильных ветеринарных препаратов? Вероятно, пределы здесь должны быть такими, чтобы обеспечить микробиологическую чистоту самой лекарственной формы. Премиксы для лечебных кормов должны соответствовать требованиям статьи 5.1.4 Европейской Фармакопеи (Ph. Eur.) «Микробиологическая чистота нестерильных лекарственных средств и фармацевтических субстанций» (Microbiological quality of non-sterile pharmaceutical preparations and substances for pharmaceutical use). Эта статья содержит специальные положения для премиксов для лечебных кормов для ветеринарного применения с использованием вспомогательных веществ растительного происхождения, для которых предварительная антимикробная обработка невозможна:
- общее число аэробных микроорганизмов 105 КОЕ в 1 г (мл);
- общее число дрожжевых и плесневых грибов 104 КОЕ в 1 г (мл);
- не более 104 КОЕ грамотрицательных бактерий, толерантных к желчи в 1 г (мл);
- отсутствие Escherichia coli в 1 г (мл);
- отсутствие бактерий рода Salmonella в 25 г (мл).
Хранение образцов ветеринарных препаратов в упаковке большого объема
На прошедшем в феврале этого года вебинаре проекта PharmPRO «Управление качеством: актуальные вопросы» [16] был озвучен следующий вопрос из чата: «Бывает так что фасовка выпускаемых препаратов большая (20-25 кг мешок) — в архив нужно закладывать препарат в полном объеме? Или можно изготовить меньший размер из той же упаковки (мешка) и вместе с образцом заложить мешок как образец?».
Чтобы представить себе о каких продуктах и упаковках может идет речь, достаточно внимательно посмотреть текст пункта 8. в Приложении 4 к Правилам GMP ЕС [3] — здесь как раз упомянуты премиксы, о которых шла речь выше. Премиксы для лечебных кормов действительно имеют упаковки большого объема.
Что касается архивных образцов (retention samples), то в пунктах 8. и 9. этого Приложения есть ответ на заданный вопрос. В связи с большими объемами окончательных упаковок некоторых ветеринарных лекарственных средств, в частности премиксов, для производителя может оказаться неудобным хранить образцы каждой серии продукции в их окончательной упаковке. Однако производитель должен обеспечить хранение достаточного количества архивных образцов каждой серии продукции в соответствии с требованиями Правил. В любом случае, упаковка для хранения архивных образцов должна быть произведена из того же материала, что и первичная упаковка, в которой этот продукт реализуется на рынке.
Что касается контрольных образцов (reference samples), то здесь уже есть ограничение, установленное требованием пункта 4.1. Приложения 19 к Правилам GMP EC [17]/Правилам GMP ЕАЭС [2]. Количество контрольных образцов должно быть достаточным для проведения не менее чем двукратного полного аналитического контроля серии продукции в соответствии с требованиями регистрационного досье, оцененного и утвержденного соответствующим компетентным органом/органами.
В 2019 году в рамках IV Всероссийской GMP-конференции с международным участием состоялся
круглый стол «Актуальные вопросы инспектирования производителей лекарственных средств для ветеринарного применения на соответствие требованиям надлежащей производственной практики». На этом круглом столе был задан вопрос про хранение образцов ветеринарных препаратов в упаковке большого объема для изучения стабильности. Представлявший инспекторат ФГБУ «ВГНКИ» Данил Рудняев ответил так: «Ветеринарные лекарственные препараты могут расфасовываться в канистры, бочки, барабаны, потому что применяются для больших животных в больших объемах. Если мы говорим о количестве в полкилограмма, то я не думаю, что у предприятия возникнут проблемы с тем, чтобы заложить полукилограммовый пакет для последующего изучения стабильности. Если у нас канистра больше 5 литров, то можно упаковывать в меньшие объемы. Причем количества должно хватить на все испытания стабильности в течение всего срока годности».
Нанесение стикеров на упаковку ветеринарных препаратов
О возможности нанесения стикеров на упаковку ветеринарных препаратов в странах Европейского Союза написано в документе EMA/CMDv/717292/2021 «Рекомендации по маркировке и упаковке ветеринарных лекарственных препаратов» (Recommendations on labelling and packaging of veterinary medicinal products) [18], подготовленном Координационной группой по взаимному признанию и децентрализованным процедурам ветеринарных лекарственных препаратов (CMDv).
ЕС наклеивание на упаковку на иностранном языке стикера на национальном языке может быть разрешено некоторыми государствами-членами, если оно выполняется в соответствии с условиями GMP. Однако в Австрии, Бельгии, Хорватии, Чехии, Дании, Германии, Греции, Лихтенштейне, Норвегии, Польше, Португалии, Испании, Швеции и Великобритании необходимо выполнить дополнительные требования, и такой подход допускается только в исключительных случаях. В Финляндии нанесение стикеров недопустимо. В ряде европейских стран условия нанесения стикеров могут быть, например, такими:
- только в исключительных/индивидуальных случаях из соображений безопасности (вероятность фальсификации, путаницы и т. д.);
- только в обоснованных случаях при условии, что стикер нельзя удалить, не повредив первичную информацию, и на стикере указана вся информация, предусмотренная для продукта;
- только в качестве исключения, при условии, что читаемость не ухудшается и маркировка соответствует утвержденному тексту и национальным требованиям;
- только для параллельного импорта;
- только если это сделано до выпуска серии и пр.
Хранение первичных упаковок иммунобиологических ветеринарных препаратов до их маркировки и упаковки
В пункте 63. Приложения 5 к Правилам GMP EC [4]/Правилам GMP ЕАЭС [2] среди прочего говорится о необходимости обеспечить надлежащие условия хранения первичных упаковок до их маркировки и упаковки. Особое внимание следует уделять хранению термолабильной и светочувствительной продукции. Температура хранения должна быть установлена.
Как контролируется температура и время хранения полупродукта? Производители должны разработать процедуры, описывающие последовательность действий, выполняемых ответственным персоналом предприятия при производстве, хранении и транспортировке иммунобиологических препаратов (в том числе для полупродуктов) с соблюдением условий холодовой цепи. Должна иметься документально подтвержденная информация о том, что за время производства продукции до момента ее отгрузки с предприятия, суммарное время ее нахождения вне заданных температурных условий не превышает значений, установленных на основании данных о термостабильности. Хранение должно осуществляться в специально оборудованных помещениях, поддерживающих установленный температурный режим в течение всего времени хранения и при любой допустимой степени загрузки, подтвержденной валидацией. Данные о термостабильности должны быть распределены между всеми этапами в цепи поставок для мониторинга суммарного времени нахождения продукции вне заданных температурных условий. В соответствии с этими данными, каждому этапу в производстве должно соответствует определенное допустимое время. Суммарное время нахождения вакцины вне заданных температурных условий (Time out of Refrigeration, ToR) должно включать все производственные операции, транспортировку внутри/между производственными площадками и подготовку к отгрузке. Оно должно быть подсчитано и оценено до выдачи разрешения на реализацию готовой продукции.
Представленный материал подготовлен с использованием данных, актуальных на 26.02.2024. В случае получения новых или дополнительных данных статья может быть обновлена.
Константин Морозов
ССЫЛКИ:
- The rules governing medicinal products in the European Union — Volume 4 — EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use. URL: https://health.ec.europa.eu/medicinal-products/eudralex/eudralex-volume-4_en (дата обращения 26.02.2024)
- Евразийский экономический союз / Решение Совета Евразийской экономической комиссии от 03.11.2016 г. № 77 «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза». URL: https://docs.eaeunion.org/docs/ru-ru/01411921/cncd_21112016_77 (дата обращения 26.02.2024)
- The rules governing medicinal products in the European Union — Volume 4 — EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use / Annex 4 — Manufacture of Veterinary Medicinal Products other than Immunological Veterinary Medicinal Products. URL: https://health.ec.europa.eu/document/download/940ed86d-0537-46aa-b43e-1b8f32bc7418_en?filename=anx04en200408_en.pdf (дата обращения 26.02.2024)
- The rules governing medicinal products in the European Union — Volume 4 — EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use / Annex 5 — Manufacture of Immunological Veterinary Medicinal Products. URL: https://health.ec.europa.eu/document/download/c14c2480-2473-4866-bf2b-d0b7ac61bc27_en?filename=anx05en200408_en.pdf (дата обращения 26.02.2024)
- EMA / Human regulatory / Research and development / Compliance / Good manufacturing practice / Working group / Concept papers, reflection papers and draft guidelines / Concept paper on the revision of annex 4 of the guidelines on good manufacturing practice — manufacture of veterinary medicinal products other than immunologicals. URL: https://www.ema.europa.eu/en/documents/scientific-guideline/concept-paper-revision-annex-4-guidelines-good-manufacturing-practice-manufacture-veterinary-medicinal-products-other-immunologicals_en.pdf (дата обращения 26.02.2024)
- EMA / Human regulatory / Research and development / Compliance / Good manufacturing practice / Working group / Concept papers, reflection papers and draft guidelines / Concept paper on the revision of annex 5 of the guidelines on good manufacturing practice for medicinal products – manufacture of immunological veterinary medicinal products. URL: https://www.ema.europa.eu/en/documents/scientific-guideline/concept-paper-revision-annex-5-guidelines-good-manufacturing-practice-medicinal-products-manufacture-immunological-veterinary-medicinal-products_en.pdf (дата обращения 26.02.2024)
- Beyene A., Kebede S., Zeru H. «Rational use of veterinary drugs and vaccines» training manual First Edition, 2016 (дата обращения 02.2024)
- CoLab / Animal Health Product Packaging: 6 Things to Consider Before Selecting a Supplier. URL: https://colabpackaging.com/blog/animal-health-product-packaging-6-things-to-consider-before-selecting-a-supplier (дата обращения 26.02.2024)
- CRB / Insights / The top innovations in animal health pharmaceuticals manufacturing. URL: https://www.crbgroup.com/insights/animal-health-processing-facilities (дата обращения 26.02.2024)
- Godefroy С., Comte S., Sandikli M.-S., Cruz-Dousdebes P., Boyer W., Soares R. Mastering frozen vaccine integrity and operator — International Hatchery Practice, volume 35, number 6, pages 7, 9 (дата обращения 02.2024)
- The rules governing medicinal products in the European Union — Volume 4 — EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use / Annex 2 — Manufacture of Biological Active Substances and Medicinal Products for Human Use. URL: https://health.ec.europa.eu/system/files/2019-02/2018_annex2_enpdf (дата обращения 26.02.2024)
- Федеральный портал проектов нормативных правовых актов / Проект постановления Правительства Российской Федерации «Об утверждении Правил маркировки лекарственных препаратов для ветеринарного применения средствами идентификации и особенностях внедрения государственной информационной системы мониторинга за оборотом товаров, подлежащих обязательной маркировке средствами идентификации, в отношении лекарственных препаратов для ветеринарного применения». URL: http://regulation.gov.ru/p/144759 (дата обращения 26.02.2024)
- Фармацевтический вестник / Новости / Регуляторика / Минпромторг сообщил о внесении в правительство проекта о маркировке ветпрепаратов. URL: https://pharmvestnik.ru/content/news/Minpromtorg-soobshil-o-vnesenii-v-pravitelstvo-proekta-o-markirovke-vetpreparatov.html (дата обращения 26.02.2024)
- EUR-Lex / Regulation (EU) 2019/6 of the European Parliament and of the Council of 11 December 2018 on veterinary medicinal products and repealing Directive 2001/82/EC (Text with EEA relevance). URL: https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32019R0006 (дата обращения 26.02.2024)
- NPRA / Guideline on Good Manufacturing Practice (GMP) for Veterinary Premixes. URL: https://npra.gov.my/images/Guidelines_Central/Guidelines_on_Veterinary/Guidelines-on-GMP-for-Veterinary-Premixes-January-2015.pdf (дата обращения 26.02.2024)
- PharmPRO / Вебинары / Управление качеством: актуальные вопросы. URL: https://events.pharmpro.pro/vebinar-quality-020224 (дата обращения 26.02.2024)
- The rules governing medicinal products in the European Union — Volume 4 — EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use / Annex 19 — Reference and Retention Samples. URL: https://health.ec.europa.eu/document/download/b9b0cf46-07a6-4243-b801-446ccfcd2d72_en?filename=2005_12_14_annex19_en.pdf (дата обращения 26.02.2024)
- HMA / Veterinary Medicines / CMDv / Procedural guidance / General Information on Applications/ Recommendations on labelling and packaging of veterinary medicinal products. URL: https://www.hma.eu/fileadmin/dateien/Veterinary_medicines/CMDv_Website/Procedural_guidance/SPC__Labelling_and_Package_leaflet/POS_Labelling_and_packaging_recommendations.pdf (дата обращения 26.02.2024)


