
Константин Морозов, специалист по GMP, аудитор фармацевтических предприятий
В соответствии с требованиями Правил надлежащей производственной практики (Good Manufacturing Practice, GMP), производитель лекарственных средств должен доказать, что при использовании предусмотренных материалов и оборудования процесс позволяет постоянно производить продукцию требуемого качества. Среди контрольных вопросов, представленных в меморандуме PIC/S PI 028-2 «GMP инспекция, связанная с упаковкой» (GMP inspection related to packaging) [1], есть следующий: «Покажите мне квалификацию/валидацию упаковочного оборудования/процесса». В этой части статьи мы рассмотрим валидацию процесса упаковки.
Как отмечено в п. 6.2.1 рекомендации PIC/S PI 006-3 «Валидационный мастер-план, IQ, OQ, валидация нестерильного процесса, валидация очистки» (Validation-Master Plan, IQ, OQ, non-sterile Process Validation, Cleaning Validation) [2], любой процесс производства или упаковки будет включать ряд факторов, которые могут повлиять на качество продукта. Эти факторы будут определены в ходе разработки продукта и облегчат исследования по оптимизации процесса. По завершении разработки и оптимизации валидация процесса обеспечивает структурированный способ методической оценки факторов, которые влияют на конечный продукт.
При рассмотрении этой темы мы не будем затрагивать валидацию процессов, проводимых в асептических условиях, так как наполнение стерильной продукции, как правило, не следует рассматривать как часть процесса упаковки.
По теме валидации процесса упаковки существует весьма ограниченное количество нормативных документов и статей. Мы воспользуемся следующими материалами:
- Приложение 15 к Правилам надлежащей производственной практики Евразийского экономического союза «Требования к квалификации и валидации», утвержденное Решением Совета ЕЭК от 04.07.2023 г. № 76 [3], далее — Приложение 15 к Правилам GMP ЕАЭС;
- Руководство GHTF/SG3/N99-10:2004 (Edition 2) «Системы менеджмента качества — Руководство по валидации процесса» (Quality Management Systems — Process Validation Guidance) [4] — далее документ GHTF;
- Дискуссионный документ ISPE «Обзор валидации упаковки лекарственных средств» (Overview of Packaging Validation for Drug Products) [5], далее — дискуссионный документ ISPE;
- Вопросы и ответы инспектората ФГБУ «ВГНКИ» во время круглого стола для производителей ветеринарных препаратов в рамках VI Всероссийской GMP-конференции, далее — сессия Q&A-2021.
Квалификация оборудования и валидация процесса
В Приложении 15 к Правилам GMP ЕАЭС [3] есть отдельный раздел «Валидация процесса упаковки», в котором приведено всего два пункта, и оба они говорят только о квалификации упаковочного оборудования. В пункте 7.1. говорится о том, что изменение технологических параметров оборудования, в особенности параметров оборудования, используемого в процессе первичной упаковки, может оказать существенное влияние на целостность и надлежащее функционирование упаковки (например, блистеры, саше и стерильные компоненты), поэтому оборудование, используемое в рамках процессов первичной и вторичной упаковки готовой и нерасфасованной продукции, должно быть квалифицировано. Квалификация эксплуатации (PQ) и валидация процесса могут выполняться отдельно, но производители могут совмещать эти стадии, выполняя несколько циклов упаковки с использованием серий коммерческого продукта.
| Можно ли объединить валидацию процесса упаковки с квалификацией оборудования для упаковки, то есть совместить отчеты PQ и валидации процесса?
В соответствии с п. 3.13. Приложения 15 к Правилам GMP ЕАЭС [3], в некоторых случаях возможно проведение квалификации эксплуатации одновременно с квалификацией функционирования или валидацией процесса производства. Ответ на данный вопрос также был дан во время сессии Q&A-2021 (на вопрос 3): «Правила GMP дают такую возможность, поэтому можно объединить их, но это должно быть четко разграничено по документам и этапам». |
Несмотря на то, что область применения руководства GHTF [4] ограничивается медицинскими изделиями, этот документ предоставляет производителям общие рекомендации по подходу к валидации процесса, которые не являются отраслевыми. Отдельные этапы производства медицинских изделий, такие как сборка и упаковка, достаточно близки к упаковке лекарственных средств. Приведенные в данном руководстве определения демонстрируют связь PQ и валидации процесса:
- «квалификация эксплуатации» (PQ) — это установление с помощью объективных доказательств того, что процесс при ожидаемых условиях постоянно производит продукт, который соответствует всем предопределенным требованиям;
- «валидация процесса» — это установление с помощью объективных доказательств того, что процесс постоянно производит результат или продукт, соответствующий его предопределенным требованиям.
При этом соображения PQ включают:
- фактические параметры продукта и процесса, а также процедуры, установленные на стадии квалификации функционирования (OQ);
- приемлемость продукта;
- гарантия возможностей процесса, установленного на стадии OQ;
- повторяемость процесса, долгосрочная стабильность процесса.
На этой стадии основная цель заключается в демонстрации того, что процесс позволит стабильно производить приемлемую продукцию в нормальных условиях эксплуатации.
Проблемы в ходе процесса должны имитировать условия, которые будут встречаться при реальном производстве. Проблемы должны включать в себя ряд условий, определенных различными уровнями действий, разрешенными в письменных стандартных операционных процедурах, установленных на стадии OQ. Проблемы должны быть повторены достаточное количество раз для гарантии того, что результаты являются значимыми и согласованными.
В статье «Квалификация эксплуатации упаковки — подход на основе оценки рисков» (Packaging Performance Qualification: A Risk-Based Approach) [6] нормальное [рутинное] производство и стадия PQ, которая должна его имитировать, проиллюстрированы следующим образом:
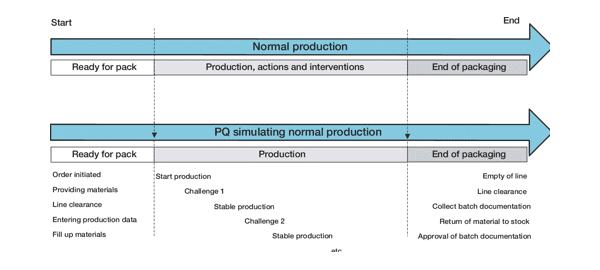
По мнению авторов, стадия PQ должна включать в себя те же основные элементы, что и нормальное [рутинное] производство:
- подготовка (инициация заказа, получение материалов, line clearance*, ввод производственных данных, загрузка материалов);
- производство;
- завершение производства (опорожнение линии, line clearance, комплектация документации на серию, возврат материалов на склад, одобрение документации на серию).
При этом если нормальное [рутинное] производство характеризуется регулярным вмешательством в работу линии во время производства путем выполнения каких-либо действий и оперативных мер, то эти аспекты должны быть также сымитированы с помощью «сконструированных» проблем. *понятие line clearance, которое используется в пункте 5.50 Правил GMP ЕС (EU GMP) [7], мы подробно разбирали в первой части статьи.
| Почему изменение технологических параметров оборудования для первичной упаковки может нести более высокие риски?
Первичная упаковка должна защищать продукт от всех неблагоприятных внешних воздействий, которые могут изменить его свойства. Как отмечают авторы дискуссионного документа ISPE [5], первичная упаковка, в которой находится открытый продукт, обычно является местом, где ожидаются более высокие риски (риск для пациента). Вторичная упаковка также важна из-за нормативных требований к печати этикеток, номеру серии и датам (и сериализации). С точки зрения реального риска для пациента или продукта риски во вторичной упаковке должны быть минимальными, если оборудование было правильно специфицировано, закуплено и тщательно протестировано. |
В пункте 7.2. Приложения 15 к Правилам GMP ЕАЭС [3], написано, что квалификация оборудования, задействованного в процессе первичной упаковки, должна быть проведена при минимальных и максимальных значениях, установленных для критических параметров процесса (CPP), таких как температура, скорость работы оборудования, усилие склейки (запайки), или для любых других факторов, влияющих на процесс первичной упаковки.
| Почему квалификация оборудования, задействованного в процессе первичной упаковки, должна быть проведена при минимальных и максимальных значениях?
В соответствии с п. 3.11. Приложения 15 к Правилам GMP ЕАЭС [3], стадия OQ может включать в себя испытания, направленные на подтверждение верхних и нижних рабочих пределов и (или) условий «наихудшего случая». Несколько примеров, объясняющих почему квалификация оборудования для первичной упаковки (в рассматриваемом случае — блистерной машины) должна быть проведена при минимальных и максимальных значениях, приведены в блоге Pharmaceutical Updates, автором которого является Чандрасекар Панда [8]: Почему проверка блистерной машины должна быть проведена при низкой и высокой температуре узла формования пленки [при получении блистеров методом термоформования]? Низкая температура формования может привести к недостаточной глубине блистерных ячеек, а высокая температура может привести к деформации формовочной пленки. Почему проверка блистерной машины должна быть проведена при низкой и высокой температуре узла термосварки? Свариваемость формовочной пленки с покрывающей алюминиевой фольгой зависит от температуры сварки. Низкая температура сварки приводит к недостаточному свариванию, что приводит к непрохождению испытания блистерной упаковки на герметичность. Высокая температура сварки может привести к деформации формовочной пленки и неблагоприятному воздействию на продукт. Почему проверка блистерной машины должна быть проведена при низкой и высокой скорости работы? Скорость работы машины определяет время контакта пленки [и фольги со сварочными плитами/роликами] во время термосварки, и это может повлиять на стабильность продукта в конечной упаковке. Скорость работы машины может также повлиять на качество нанесения информации на блистерную упаковку. |
Форматы
Необходимо определить широту форматов, которые будет охватывать квалификация/валидация. Авторы статьи «Квалификация эксплуатации упаковки — подход на основе оценки рисков» [6] считают, что поскольку PQ в целом должна имитировать нормальное [рутинное] производство, количество необходимых циклов PQ должно отражать количество основных форматов или основных вариаций, которые технические специалисты настраивают между разными заказами. Конфигурации основного формата для упаковки будут зависеть от основных целей оборудования, обычно определяемых по конкретным промышленным параметрам, и перечислены ниже.
- Разные продукты:
Упаковочные линии могут использоваться для упаковки нескольких продуктов при условии, что основная форма продукта и первичная упаковка одинаковые, например, таблетки одинаковой формы с разными действующими веществами. Обычно это требует использования разных систем подачи и/или разных параметров обработки, поскольку физические и/или химические свойства будут варьироваться от действующего вещества к действующему веществу. Кроме того проблемой могут быть барьеры, препятствующие смешиванию таблеток с разными действующими веществами, а также упаковка в правильные упаковочные материалы. - Разные дозируемые количества:
Линия может быть спроектирована так, чтобы фасовать и упаковывать как по 3 мл, так и по 10 мл, или она может быть спроектирована для фасовки и упаковки по 10, 100 и 500 таблеток в контейнер. Обычно это требует замены некоторых частей формата на узле нанесения этикеток. - Разное количество первичных упаковок в картонной пачке:
Часто продукт продается с разным количеством первичных упаковок в пачке, например, по 3, 5 или 10 единиц в пачке, а также часто по 1 единице в пачке. Как правило, это затрагивает форматы картонажной машины, которые необходимо изменить. - Разные размеры листка-вкладыша/инструкции по применению, помещаемых в упаковку вместе с продуктом:
Поскольку разные страны имеют разные требования к содержанию, а в ряде стран требуется, чтобы текст листка-вкладыша/инструкции был напечатан на всех официальных языках, очевидно, что это будет влиять на размер листка-вкладыша/инструкции. - Разная конфигурация упаковки:
Поскольку в некоторых странах реклама разрешена, а в других запрещена, то часто бывает так, что лучше иметь возможность добавить в упаковку больше или меньше информационных или рекламных материалов.
В дискуссионном документе ISPE [5] говорится о том, что формат представляет собой комбинацию различных атрибутов препарата/упаковки и параметров оборудования/процесса, которые в сочетании составляют уникальную упаковку/процесс. Упаковочные линии могут быть специализированными или очень разнообразными с точки зрения того, как конфигурируются различные процессы и используются различные компоненты. Авторы документа предлагают разрабатывать матрицу продукта. Выбор атрибутов, которые будут использоваться в матрице, должен учитывать влияние на критические показатели качества (CQA), параметры процесса и используемый комплект оборудования.

Брекетинг
В пункте 5.4. Приложения 15 к Правилам GMP ЕАЭС [3], написано, что применение подхода выбора крайних вариантов (брекетинга) может быть обосновано для новых видов продукции на основе специальных знаний о процессе производства, если такие знания были получены в ходе фармацевтической разработки лекарственного препарата и его производства, в совокупности с приемлемой программой продолжающейся верификации.
Как правило, для форматов упаковки подход брекетинга применяется с целью повышения эффективности усилий по валидации, пишут авторы дискуссионного документа ISPE [5].
При этом они подчеркивают, что брекетинг может быть неприемлем на некоторых рынках или он может быть неподходящим, например, в случае ограниченных знаний или опыта для продукта или процесса.
| Возможен ли при валидации процесса упаковки подход брекетинга? Допустимо ли тестировать только различные типы упаковки, если СРР будут идентичны для всех дозировок?
В соответствии с п. 5.5. Приложения 15 к Правилам GMP ЕАЭС [3], подход брекетинга может быть применен для различных размеров упаковки или различных объемов наполнения одного и того же контейнера. Следует помнить, что в требованиях ЕАЭС говорится о том, что применение брекетинга к разным дозировкам, размерам серий продукции и размерам (типам) упаковки возможно в случае письменного обоснования возможности такого подхода в документах по валидации и регистрационном досье лекарственного препарата. Ответы на вопросы по брекетингу (на вопросы 2 и 5) во время сессии Q&A-2021 были следующими: «Брекетинг в какой-то степени возможен, если есть полная идентичность упаковки: одинаковые размеры, одинаковые картонные коробки, этикетки, если переменная информация наносится в том же самом месте и тем же самым способом». «Если речь идет о количестве блистеров, упаковываемых во вторичную упаковку, то если у этих блистеров одинаковое количество ячеек и одинаковые размеры, переменная информация наносится в том же самом месте и тем же самым способом, одинаковые по размеру картонные коробки, тогда если при этом в блистер будут упаковываться таблетки одинакового размера с различными дозировками, то здесь проблемы я не вижу. Здесь нас интересует процесс упаковки, а не дозировка таблеток, находящихся в блистерных ячейках». |
Количество циклов/cерий и их размер
Многие считают, что для валидации процесса нужно всегда использовать только три серии/цикла, однако это не совсем верно.
Как рассуждает Марк Аллен Дьюриваж, главный управляющий консультант компании Quality Systems Compliance LLC в статье «Как установить количество циклов, необходимых для валидации процесса» (How To Establish The Number Of Runs Required For Process Validation) [9], даже те, у кого ограниченные познания в статистике, поймут, что три цикла не является статистически значимыми. А те, кто владеет статистическими методами, уже знают, что выборка из трех не является значимой. Если бы производитель использовал теорему «success-run» для определения количества циклов валидации процесса, используя 95% достоверности и 90% надежности, ему потребовалось бы 30 циклов. Однако 30 циклов — это непрактично и нерентабельно. Кроме того, некоторые продукты могут производиться только время от времени.
При традиционный подходе к валидации процесса, описанном в Приложении 15 к Правилам GMP ЕАЭС [3], выбор количества производимых серий продукции должен основываться на принципах управления рисками для качества и позволять установить рабочий диапазон вариаций и тенденций к изменению. Требуется установить количество серий продукции, необходимых для подтверждения того, что в процессе производства может быть обеспечено стабильное получение качественной продукции.
| Какое количество серий продукции необходимо для валидации процесса упаковки?
В общем случае, описанном в п. 5.20. Приложения 15 к Правилам GMP ЕАЭС [3], приемлемым для валидации процесса считается как минимум 3 последовательные серии при рутинных условиях. Здесь речь идет в первую очередь о первоначальной валидации. Во время сессии Q&A-2021 прозвучал следующий комментарий о числе серий при валидации процесса упаковки (к вопросу 2): «Здесь принципы остаются теми же самыми: как минимум три последовательные серии, и если больше — то лучше». В своей презентации во время круглого стола в рамках выставки Pharmtech & Ingredients 2024 [10], советник директора ФГБУ «ВГНКИ» Данил Рудняев привел перечень наиболее часто встречающихся несоответствий при инспектировании. В этом перечне есть следующее несоответствие: «Валидация проведена не на трех (последовательных) сериях продукции (в заданных параметрах)». Комментируя текст п. 5.20., он добавил: «Доказать, что количество валидационных серий может быть меньше трех, очень сложно». С этим действительно трудно поспорить, потому что подход производителя, представленный в анализе рисков, должен быть грамотно обоснован. |
В Приложении 15 к Правилам GMP ЕАЭС [3] также говорится о том, что может быть обосновано иное [по отношению к трем] количество серий продукции, принимая во внимание использование стандартных методов производства и наличие уже применяемых на предприятии аналогичных процессов производства или аналогичной продукции.
По мнению авторов дискуссионного документе ISPE [5], для продукта/процесса с низким остаточным риском может потребоваться только одна серия для валидации, если используется очень похожий на существующий процесс упаковки; тогда как для продукта/процесса с высоким остаточным риском может потребоваться несколько серий. В документе приведены некоторые факторы, на которых следует сосредоточиться при анализе рисков для валидации процесса упаковки, такие как:
- опыт и понимание продукта и процесса;
- принятые стратегии контроля (стратегия контроля должна детализировать и управлять уровнем вариации от входных данных продукта и процесса, включая, например, количество операторов, различные смены и различные источники/серии используемых материалов; потенциальная вариация в этих примерах может контролироваться надежной программой обучения операторов, а вариация материалов контролируется жесткими допусками, подробно описанными в контролируемых и утвержденных спецификациях материалов);
- сложность;
- воздействие на пациента;
- уровень и продолжительность PQ;
- знание аналогичной линии/оборудования/процессов и др.
| Допустимо ли при валидации процесса упаковки уменьшение размера второй и третьей валидационных серий, при условии, что первая серия, использованная при валидации, была максимального размера (размер этой серии был равен размеру серии при промышленном выпуске продукции)?
Ответ на данный вопрос (на вопрос 4) во время сессии Q&A-2021 был таким: «Валидиционные серии должны иметь тот же размер, что и размер серий при промышленном выпуске. Также мы говорим здесь о ситуации «наихудшего случая», потому что количество внутрипроизводственных контролей при упаковке таких серий будет увеличено и само функционирование оборудования при длительном периоде времени также значимо». Действительно, п. 5.8. Приложения 15 к Правилам GMP ЕАЭС [3] говорит о том, что валидационные серии должны иметь тот же размер, что и планируемые серии продукции для коммерческого использования. В то же время в аналогичном пункте Приложения 15 к EU GMP [11] формулировка требования более лаконична: обычно валидационные серии должны иметь тот же размер, что и планируемые серии продукции для коммерческого использования. |
И в требованиях ЕАЭС, и в требованиях ЕС есть допущение о том, что использование других размеров валидационной серии продукции необходимо обосновать. При этом документ ЕАЭС требует обосновать это в документах по валидации исходя из критических факторов, влияющих на процесс валидации. Давайте порассуждаем на эту тему.
Разделение одной серии нерасфасованной продукции на этапе упаковки на две или несколько серий готовой продукции является достаточно распространенной практикой. Такая необходимость может быть обоснована разными причинами, как коммерческими, так и связанными с обеспечением качества.
Например, разделение серии балка покрытых оболочкой таблеток на несколько серий готовой продукции может быть вызвано отличием оттенка цвета оболочки у разных под-серий (во второй части статьи я описывал такой случай из практики, когда серия нерасфасованной продукции могла быть получена в результате нескольких операций покрытия таблеток оболочкой).
Или мы можем рассмотреть другой пример, когда разделение серии балка на две серии готовой продукции требуется для того, чтобы использовать остаток упаковочного материала от другого производителя (в четвертой части статьи я описывал такую ситуацию с картонными пачками, между которыми могут быть визуально определяемые различия).
В первом из рассмотренных случаев размер серий готовой продукции будет определяться размером под-серий, полученных на этапе покрытия таблеток оболочкой. Во втором случае размер серий готовой продукции может быть разным (в зависимости от остатка упаковочного материала, который необходимо использовать).
Таким образом, мы приходим к тому, что при валидации процесса упаковки было бы полезно иметь результаты для серий, размер которых может быть меньше, чем у коммерческих серий продукции. Я бы предложил проводить валидацию на трех сериях: две из них имели бы тот же размер, что и планируемые коммерческие серии продукции; третью серию балка я бы на этапе упаковки разделил еще на три серий готовой продукции, например, в соотношении 10%-30%-60%. Ситуацией «наихудшего случая» (по времени) здесь может быть упаковка серии с размером 10% от коммерческой серии продукции. Если упаковка такой серии осуществляется на высокоскоростной упаковочной линии, то оборудование будет функционировать короткий период времени и количество дополнительных внутрипроизводственных контролей будет меньшим.
Интересный кейс по валидации процесса упаковки изложен руководителем группы по работе с клиентами компании Almac Ребеккой Тумелти в презентации «Ключевые операционные соображения для валидации и упаковки в поддержку запуска продукта» (Key Operational Considerations for Validation and Packaging in Support of a Product Launch) [12].
Квалификация процесса:
- были выполнены 2 производственных цикла, выполненных операционным персоналом, в соответствии с протоколом и проектом основной записи на серию (MBR), имитирующих повторяемый цикл упаковки;
- из-за доступности продукта для каждого цикла использовалась половина серии таблеток, чтобы гарантировать, что была репрезентативность целой коммерческой серии;
- были протестированы экстремальные эксплуатационные значения скорости линии и температуры, с увеличенным количеством внутрипроизводственных контролей.
Валидация процесса:
- была завершена упаковка 3 серий коммерческого размера, в данном случае с коммерческим продуктом;
- установленные диапазоны работы были внесены в полностью утвержденную запись по упаковке в блистеры, для коммерческой серии;
- валидация процесса маркировки блистеров и упаковки в чехлы была завершена с использованием тестовых компонентов, репрезентативных для коммерческой упаковки.
Планы отбора проб
При традиционный подходе к валидации процесса, описанном в Приложении 15 к Правилам GMP ЕАЭС [3], выбор количества отбираемых проб должен основываться на принципах управления рисками для качества и позволять установить рабочий диапазон вариаций и тенденций к изменению.
В Приложении А к руководству GHTF [4] описываются различные статистические методы и инструменты, которые могут использоваться при валидации процесса. Планы выборочного контроля могут быть полезны для оптимизации количества образцов, подлежащих испытанию, и для демонстрации соответствия спецификации. Одним из методов статистического анализа и управления качеством продукции является выборочный контроль по альтернативному признаку.
При упаковке он обычно используется в качестве альтернативы 100%-ному контролю (если в процесс проверки выборки вовлечено разрушающее испытание, этот план выборочного контроля является наиболее ресурсоемким). Объем выборки может определяться по ISO 2859-1:1999 «Статистические методы. Процедуры выборочного контроля по альтернативному признаку. Часть 1. Планы выборочного контроля последовательных партий на основе приемлемого уровня качества» (Sampling procedures for inspection by attributes. Part 1: Sampling schemes indexed by acceptance quality limit (AQL) for lot-by-lot inspection) [13]. Авторы дискуссионного документа ISPE [5] отмечают, что только браковочный уровень качества (RQL) обеспечивает статистическую гарантию того, что уровень дефектов в серии ниже определенного уровня.
Поэтому типичный подход к балансировке AQL и RQL заключается в установке валидационного уровня RQL в качестве запланированного уровня критичности рутинного выпуска (часто называемого уровнем AQL). Этот подход обеспечивает статистическую уверенность (до определенного уровня уверенности), что уровень дефектов в серии не превышает допустимого уровня критичности рутинного выпуска.
Анализ результатов
Процесс упаковки считается валидированным, если:
- все использованные в технологическом процессе единицы производственного и контрольного оборудования и инженерные системы прошли все стадии квалификации, поверку/калибровку;
- использованные методики испытаний прошли валидацию;
- в процессе упаковки, при внутрипроизводственных контролях не обнаружено критических и значительных отклонений;
- каждое обнаруженное отклонение было надлежащим образом расследовано, были предприняты незамедлительные действия, а по отношению к выявленной основой причине (причинам) этого отклонения были выполнены/запланированы корректирующие и предупреждающие действия (САРА);
- каждая серия продукции по результатам анализа соответствует требованиям нормативной документации.
Продолжающаяся верификация процесса упаковки
В соответствии с п. 5.29. Приложения 15 к Правилам GMP ЕАЭС [3], производителям необходимо осуществлять мониторинг качества продукции и оценивать релевантные тенденции процесса производства в целях обеспечения гарантии поддержания контролируемого состояния продукции на протяжении ее жизненного цикла.
Предложенный в дискуссионном документе ISPE [5] план оценки тенденций в данных по упаковке может учитывать следующие элементы, определенные на этапе проектирования и разработки:
- Определите этап упаковки (т. е. первичная, вторичная или третичная)
- Для каждого определенного этапа перечислите все следующее:
-
- CQA для компонентов и продукта;
- CPP;
- критические атрибуты материала (например, входные данные таблетки, такие как толщина или вес);
- местоположение и тип внутрипроизводственных контролей;
- требуемые и/или разрешенные выходы/отбраковку/время простоя (опционально)
- Обоснуйте, какие из них могут иметь тренды, а какие нет, используя подход, основанный на оценке риска
- Определите и обоснуйте частоту отслеживания тенденций и отчетности по критическим элементам, которые должны быть рассмотрены с использованием истории разработки/производства, оценки рисков, возможностей процесса и т. д.
- Проверяйте выполнение мероприятий по контролю изменений и, по крайней мере, ежеквартально, убеждайтесь, что обновления вносятся в соответствии с наблюдаемыми тенденциями в данных, результатами планов смягчения последствий, контроля изменений, мероприятий по повторной валидации и новыми требованиями оценки рисков или CAPA.

И снова спасибо всем тем, кто интересуется вопросами упаковки в чатах, посвященных GMP, производству и качеству лекарственных средств. Валидация процесса упаковки связана не только с программой валидации в целом, но и с соблюдением требований GMP на завершающем этапе производства. Как уже было отмечено, по валидации процесса упаковки существует весьма ограниченное количество материалов, а семинары и конференции обычно обходят эту тему стороной. Пока нам остается только изучать доступные документы и чаще встречаться. Например, мы с Бу собираемся посетить Фармацевтический Форум Евразийского отделения ISPE в Минске [14]. Мне нужно только упаковать полосатого друга валидированным способом, чтобы проводница не высадила его из поезда ☺. Представленный материал подготовлен с использованием данных, актуальных на 21.11.2024. В случае получения новых или дополнительных данных статья может быть обновлена. Константин Морозов, специалист по GMP, аудитор фармацевтических предприятий |
Ссылки:
- Pharmaceutical Inspection Co-operation Scheme / PIC/S GMP Inspection Related to Packaging (PI 028-2). URL: https://picscheme.org/docview/3822 (дата обращения 21.11.2024)
- Pharmaceutical Inspection Co-operation Scheme / PIC/S Validation-Master Plan, IQ, OQ, non-sterile Process Validation, Cleaning Validation (PI 006-3). URL: https://picscheme.org/docview/3447 (дата обращения 21.11.2024)
- КонсультантПлюс / Решение Совета Евразийской экономической комиссии от 04.07.2023 N 76 «О внесении изменений в Правила надлежащей производственной практики Евразийского экономического союза». URL: https://www.consultant.ru/document/cons_doc_LAW_454311/ (дата обращения 22.10.2024) (дата обращения 21.11.2024)
- International Medical Device Regulators Forum / GHTF/SG3/N99-10:2004 (Edition 2) Quality Management Systems — Process. Validation Guidance. URL: https://www.imdrf.org/sites/default/files/docs/ghtf/final/sg3/technical-docs/ghtf-sg3-n99-10-2004-qms-process-guidance-04010.pdf (дата обращения 21.11.2024)
- ISPE / ISPE Discussion Paper: Overview of Packaging Validation for Drug Products. URL: https://ispe.org/sites/default/files/concept-papers/overview-packaging-validation-drug-products.pdf (дата обращения 21.11.2024)
- S. Christiansen, Jesper Bønnelycke, T. Jensen. Packaging Performance Qualification: A Risk-Based Approach. Journal of validation technology volume 15, No. 4 (2009) (дата обращения 21.11.2024)
- The rules governing medicinal products in the European Union — Volume 4 — EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use / Chapter 5 — Production. URL: https://health.ec.europa.eu/system/files/2016-11/chapter_5_0.pdf (дата обращения 21.11.2024)
- Pharmaceutical Updates / Packing Validation. URL: https://pharmaceuticalupdates.com/2020/05/28/packing-validation/ (дата обращения 21.11.2024)
- Pharmaceutical Online / How To Establish The Number Of Runs Required For Process Validation. URL: https://www.pharmaceuticalonline.com/doc/how-to-establish-the-number-of-runs-required-for-process-validation-0001 (дата обращения 21.11.2024)
- Pharmtech & Ingredients. Деловая программа / Деловая программа 2024. URL: https://pharmtech-expo.ru/ru/agenda/business-program2024/ (дата обращения 21.11.2024)
- The rules governing medicinal products in the European Union — Volume 4 — EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use / Annex 15: Qualification and validation. URL: https://health.ec.europa.eu/document/download/7c6c5b3c-4902-46ea-b7ab-7608682fb68d_en?filename=2015-10_annex15.pdf (дата обращения 21.11.2024)
- Almac / Key Operational Considerations for Validation and Packaging in Support of a Product Launch. URL: https://www.almacgroup.com/wp-content/uploads/2019/09/Key-operational-considerations-for-validation-packaging-in-support-of-a-Product-Launch.pdf (дата обращения 21.11.2024)
- ISO / ISO 2859-1:1999. Sampling procedures for inspection by attributes. Part 1: Sampling schemes indexed by acceptance quality limit (AQL) for lot-by-lot inspection. URL: https://www.iso.org/ru/standard/1141.html (дата обращения 21.11.2024)
- Фармацевтический Форум Евразийского отделения ISPE. URL: https://forum_ispe.tilda.ws/ (дата обращения 21.11.2024)


