В этом году специалисты подведомственного Россельхознадзору Федерального государственного бюджетного учреждения «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГБУ «ВГНКИ») провели больше 40 инспекций производителей лекарственных средств для ветеринарного применения на соответствие требованиям Правил надлежащей производственной практики (Good Manufacturing Practice, GMP). В данном обзоре представлена информация по инспектированию, а также приведены некоторые советы и рекомендации, которые могут пригодиться производителям при подготовке к проверкам.
Результаты инспектирования
Иностранные производители
Согласно реестру выданных заключений, опубликованному на сайте Россельхознадзора 27.12.2022 г. [1], во второй половине этого года было выдано 6 заключений о соответствии требованиям Правил GMP. Эти заключения были сделаны в отношении площадок, расположенных в Бразилии, Китае, Италии и Франции. Всего в 2022 году выдано 9 GMP-заключений.
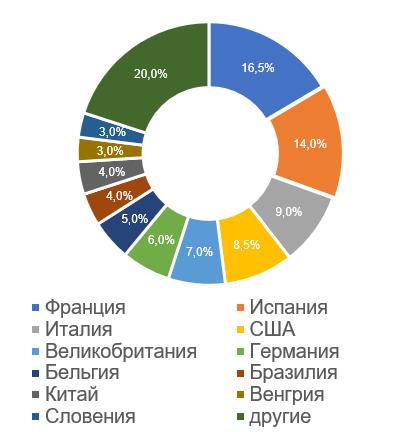
Наибольшее число российских инспекций, по результатам которых за 2017-2022 годы были приняты решения о выдаче/отказе в выдаче GMP-заключения (25, что составляет 16,5%), проведено на производственных площадках, расположенных во Франции. На сегодняшний день наибольшее число действующих заключений (6) также имеют французские площадки.
На заметку:
Мониторинг качества реализуемых во Франции лекарственных средств для ветеринарного применения проводит Национальное агентство по ветеринарным лекарственным средствам (ANMV). Благодаря своему опыту ANMV является агентством, активно участвующим как в европейской, так и в международной деятельности. Так в 2019 году, на панельной дискуссии в рамках IV Всероссийской GMP-конференции, инспектор производства фармацевтических препаратов для ветеринарии Винсент Ньювиале (Vincent Neuviale) представил информацию о GMP-инспектировании, проводимом ANMV во Франции. В начале 2022 года директор агентства посетил с рабочим визитом ФГБУ «ВГНКИ». ANMV с большим вниманием относится к результатам инспекций, проводимых российским инспекторатом на французских производственных площадках.
О французских производителях ветеринарных препаратов и агентстве ANMV можно также прочитать здесь.
Анализ результатов инспектирования в тех странах, где было проведено наибольшее число российских инспекций, сейчас показывает следующие тренды:
— Худшие результаты у производственных площадок, расположенных в США (100% отказов в выдаче заключения), Бразилии и Германии (более 80% отказов в выдаче заключения).
— Лучшие результаты у производственных площадок, расположенных в Словении (ни одного отказа в выдаче заключения), а также в Венгрии и Китае (не более 33% отказов в выдаче заключения).
При этом результаты ряда инспекций, проведенных во втором полугодии, могут стать известны только в первой половине 2023 года.
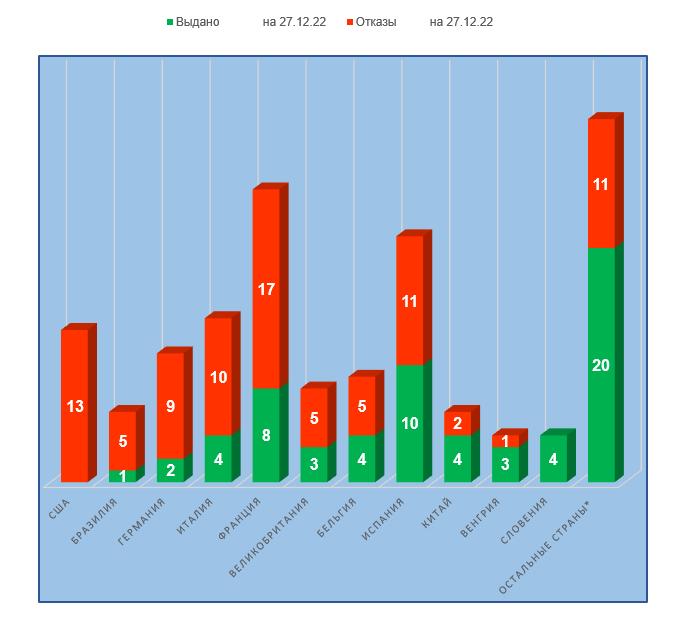
Возможно, производители из восточно-европейских стран лучше понимают российские требования. Кроме того, полностью локализованному в Российской Федерации производителю может быть легче готовиться и проходить российские инспекции. Особо стоить отметить успехи компании KRKA из Словении. История работы этой компании в России насчитывает уже несколько десятилетий. На сегодняшний день завод ООО «КРКА-РУС» в Истре является одним из самых современных заводов в России; по данным на 2021 год общая сумма инвестиций в развитие и строительство этого завода составила больше 200 миллионов евро [2]. По данным аналитической компании RNC Pharma [3], в период с января по октябрь 2022 года KRKA выступала абсолютным лидером с точки зрения натуральной динамики поставок ветеринарных препаратов в Россию (в упаковках), при этом компания продемонстрировала один из наиболее заметных показателей с точки зрения динамики отгрузок (рост в 2,3 раза). Интересно, что первая российская GMP-инспекция иностранных производителей лекарственных средств для медицинского применения состоялась именно на заводе KRKA в Словении. Не удивительно, что качественная подготовка к российским инспекциям имеет для этой компании большой приоритет.
ANMV с большим вниманием относится к результатам инспекций, проводимых российским инспекторатом на французских производственных площадках.
В Венгрии за результатами российских инспекций производителей лекарственных средств для ветеринарного применения пристально наблюдает Директорат ветеринарных лекарственных средств — подразделение Национального бюро по безопасности пищевой цепи (NÉBIH), который находится в тесном контакте с производителями.
Что касается производителей из Китая, то китайские компании могут быть мотивированы хорошо готовиться к российским инспекциям, если они хотят заменить поставки продукции из недружественных России стран. Еще в марте этого года, обсуждая с представителями Общероссийской общественной организации малого и среднего предпринимательства «Опоры России» поставки ветеринарных препаратов, руководитель Россельхознадзора Сергей Данкверт отметил, что сегодня рассматриваются производители Китая и Индии в качестве поставщиков лекарственных средств, сырья для их изготовления, кормовых добавок [4].
На заметку:
Среди присутствующих на российском рынке иностранных фармацевтических компаний по-прежнему нет ни одной компании, полностью локализовавшей производство своих ветеринарных препаратов. Но даже если компания передала на аутсорсинг производство хотя бы нескольких препаратов, то такому иностранному производителю может быть проще готовиться к российскому инспектированию. Организация аудитов контрактных производителей (Contract Manufacturing Organisation, CMO), участие в регулярном обзоре качества произведенных лекарственных препаратов и совместная оценка результатов такого обзора — это хорошая практика, помогающая лучшему пониманию локальных требований.
Российские производители
Согласно реестру на сайте Россельхознадзора [1], во второй половине текущего года было выдано 11 GMP-заключений. Эти заключения были получены следующими производственными площадками: ФКП «Ставропольская биофабрика», ООО «Апиценна», ООО «НВЦ Агроветзащита С-П.», ФГБУН «ИОС УрО РАН», ООО «Эликсир-Д», ООО «Ветлайн», АО «НПФ «Экопром», ФГУП «Московский эндокринный завод», ООО «ДЕКО-ФАРМ», ФКП «Армавирская биофабрика» и ООО «НВП «Астрафарм». Всего в 2022 году отечественным производителям было выдано 14 заключений, что больше, чем в предыдущем году.
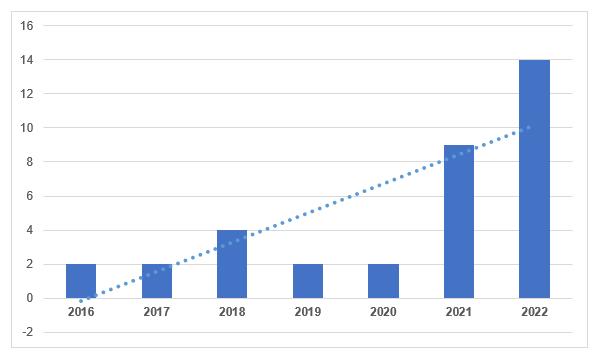
На сегодняшний день отечественные производители имеют 25 действующих заключений – практически столько же, сколько имеют иностранные производители.
На заметку:
По информации Россельхознадзора, на рынке ветеринарных препаратов в Российской Федерации сейчас работает 101 локальный производитель. К 2030 году объем производства российских ветеринарных препаратов отечественные производители намерены увеличить в 5 раз по сравнению с 2021 годом, с 24 до 100 млрд рублей, и занять 90% отечественного рынка, но при условии господдержки. Такие показатели прописаны в проекте концепции развития отрасли производства ветпрепаратов в России. Подготовкой документа занималась рабочая группа Национальной ветеринарной ассоциации (НВА). В ассоциацию входят представители отечественных производителей ветпрепаратов [5]. С марта 2022 года, в связи с вступлением в силу изменений в Федеральный закон от 04.05.2011 г. № 99-ФЗ «О лицензировании отдельных видов деятельности» [6], российские производители могут получать GMP-заключения по результатам периодического подтверждения соответствия лицензионным требованиям, которое заменило плановые проверки.
Об отечественных производителях ветеринарных препаратов можно дополнительно прочитать здесь
В первой половине этого года в некоторых СМИ высказывались сомнения в том, что российский инспекторат может проводить достаточное количество инспекций. Например, в одной из своих публикаций новостной портал RTVI ссылался на мнение директора по развитию аналитической компании RNC Pharma Николая Беспалова, который отметил, что, помимо проблем с выездными проверками на предприятиях в недружественных странах, существует недостаток и самих специалистов [7].
Однако во второй половине года российский инспекторат стал проводить значительно больше проверок. Например, в ноябре на сайте ФГБУ «ВГНКИ» была опубликована информация о том, что в период с 26 сентября по 10 ноября специалистами отдела инспекции было проведено 10 инспекций иностранных производителей лекарственных средств (включая один выезд на производственную площадку и девять инспекций по документам, в том числе в дистанционном формате с использованием аудио- или видеосвязи) [8]. Этот результат (10 инспекций за 1,5 месяца) на практике подтверждает, что текущими силами инспекторат может проводить не менее 80 инспекций в год.
На заметку:
По различным причинам некоторые производители сами просят перенести инспекции своих площадок на более поздний срок. При этом необходимо помнить о том, что инспектирование должно быть проведено в срок, не превышающий 160 рабочих дней со дня принятия уполномоченным органом решения о проведении инспектирования (в соответствии с п. 20. Постановления Правительства Российской Федерации от 03.12.2015 г. № 1314 [9]).
Прошедшие события и мероприятия
Во второй половине 2022 года в России прошло несколько мероприятий, которые могли бы быть полезными производителям для подготовки к инспектированию.
В этом году список учебных мероприятий Научно-методического базового центра ФГБУ «ВГНКИ» включал в себя 95 программ, в том числе 3 новые программы для сотрудников предприятий по производству лекарственных средств для ветеринарного применения [10].
В частности, в июле прошел онлайн-семинар об особенностях производства биологических фармацевтических субстанций и лекарственных препаратов. В ходе вебинара специалисты отдела инспекции производства на соответствие требованиям надлежащей производственной практики рассказали слушателям о специальных требованиях к разным типам продукции, исходному сырью, упаковочным материалам и персоналу биологических производств, а также о конструктивных особенностях помещений и оборудования [11].
В сентябре в Иркутске прошла VII Всероссийская GMP-конференция с международным участием, организованная Минпромторгом России совместно с ФБУ «ГИЛС и НП» [12].
В рамках конференции состоялcя круглый стол Ассоциации ветеринарных фармацевтических производителей АВФАРМ «GMP ветеринарных фармацевтических производств: тенденции и перспективы». На этом мероприятии собрались руководители органов инспекции Российской Федерации и Республики Беларусь, представители Евразийской экономической комиссии (ЕЭК) и бизнеса, а также российские и международные эксперты в области Правил GMP. Основными темами обсуждения стали изменения в механизме проведения инспекций в связи со вступлением в силу новых «Правил регулирования обращения ветеринарных лекарственных средств на таможенной территории ЕАЭС», утвержденных Решением Совета ЕЭК от 21.01.2022 г. № 1 [13], а также динамика и перспективы инспекций, проводимых российскими и белорусскими уполномоченными органами [14].
В ходе круглого стола руководитель Органа инспекции ФГБУ «ВГНКИ» Юрий Еремин рассказал о накопленном опыте проведения инспекций в дистанционном формате. Он отметил, что в отделе инспекции производства на соответствие требованиям надлежащей производственной практики на сегодняшний день работают 12 инспекторов, силами которых можно проводить до 80 инспекций в год [15].
Юрий Еремин отдельно остановился на трудностях, возникающих при представлении в уполномоченное учреждение плана корректирующих и предупреждающих действий (САРА-плана) и копий документов, содержащих мероприятия по его выполнению (в соответствии с п. 27. Постановления Правительства Российской Федерации от 03.12.2015 г. № 1314 [9]):
- неполный перевод документов; перевод, осуществленный неквалифицированным переводчиком;
- подтверждающие первичные записи не предоставляются; часто предоставляются только проекты протоколов и отчетов.
Руководитель Органа инспекции также обратил внимание на то, что на сайтах Россельхознадзора и ФГБУ «ВГНКИ» были размещены «Методические рекомендации по подготовке к дистанционной инспекции иностранного производителя лекарственных средств для ветеринарного применения» [16, 17], которыми необходимо руководствоваться при подготовке к дистанционному инспектированию.
На заметку:
Переводчикам, которые будут переводить связанные с САРА-планом документы, нужно предоставить дополнительную информацию, которая необходима им для выполнения услуг на высоком профессиональном уровне. Некоторые агентства по переводу отдельно оговаривают в договоре предоставление терминологического глоссария или иных справочно-информационных материалов. Это может быть, например, список используемых в документах аббревиатур, ранее переведенные тексты с исходными файлами, файлы переводческой памяти и т. д. Чтобы своевременно перевести все связанные с САРА-планом документы, можно начать работу по подготовке некоторых из этих документов еще в период подготовки первичного инспекционного отчета — ориентируясь на наблюдения, которые были озвучены на заключительном совещании в последний день инспекции.
Заместитель директора Департамента санитарных, фитосанитарных и ветеринарных мер ЕЭК Владимир Субботин выступил с презентацией на тему «Применение требований GMP ЕАЭС в условиях новых правил регулирования обращения ветеринарных лекарственных средств в ЕАЭС». Кроме этого, он ответил на вопросы, поступившие от участников круглого стола:
Вопрос 1: Будет ли при осуществлении регистрационных процедур в государствах-членах ЕАЭС требоваться подтверждение GMP-соответствия в отношении конкретных лекарственных препаратов/дозировок или только в отношении лекарственных форм/производственных линий?
Ответ: Инспекции осуществляются и документы выдаются в отношении конкретных производственных площадок, а если они достаточно крупные, то и в отношении отдельных производственных линий. Если на этих линиях или площадках существует производство нескольких препаратов, все они попадают под возможности регистрации на основании этих GMP-сертификатов.
Вопрос 2: Будет ли выданный GMP-сертификат взаимно признанным в двух (или более) государствах-членах ЕАЭС в том случае, если в инспектировании производителя участвовали инспектора только одного уполномоченного органа государства-члена ЕАЭС из тех государств-членов, на территории которых планируется обращение заявленных к инспекции препаратов?
Ответ: Да, сертификат, выданный одним конкретным уполномоченным органом на соответствие правилам GMP Союза будет признаваться в других государствах-членах [18].
Эксперт по GMP ветеринарных фармацевтических производств Эммануэль Мотт представила ассоциацию HealthforAnimals. В числе направлений международного сотрудничества она упомянула соглашения о взаимном признании, а также участие в таких международных организациях, как Схема сотрудничества фармацевтических инспекций (PIC/S).
Следует упомянуть, что в тот же день GMP-конференции директор ФБУ «ГИЛС и НП» Владислав Шестаков, модерируя пленарное заседание «Международное взаимодействие в сфере надлежащих практик в современных геополитических условиях», рассказал о том, что заявка России о вступлении в PIC/S была заморожена [19].
Комментируя негативные результаты российских инспекций площадок производителей иммунобиологических лекарственных средств в США, заместитель директора ФГБУ «ВГНКИ» Данил Рудняев отметил, что американским площадкам необходимо достаточно скрупулезно изучить Правила GMP ЕАЭС, утвержденные Решением Совета ЕЭК от 03.11.2016 г. № 77 [20], и провести на площадках аудиты на соответствие требованиям именно этих Правил, а не только тем требованиям, которые предъявляет Министерство сельского хозяйства США (USDA). «Нужно посмотреть, что не так, что нужно поправить в отношении тех лекарственных препаратов, которые будут заявлены к российской инспекции, и только после этого подавать заявление», — сказал Данил Рудняев.

На заметку:
«Перечень наиболее часто встречающихся несоответствий при инспектировании производителей лекарственных средств для ветеринарного применения» [21] впервые был размещен на сайте ФГБУ «ВГНКИ» в 2018 году, и он периодически обновляется. Эту информацию нужно обязательно использовать при подготовке к инспектированию. Предварительный аудит, изучение отчетов по результатам последних инспекций, контроль выполнения плана САРА, а также проработка отдельных вопросов, связанных с предстоящей российской инспекцией, очень важны при подготовке. Важно, чтобы пре-аудит проводился на всех площадках производителя, которые должны проходить инспектирование, включая площадки CMO.
Кроме того, на круглом столе выступили: начальник отдела фармацевтической инспекции ГУ «Белорусский государственный ветеринарный центр» Нина Малаш, начальник отдела инспектирования производства лекарственных средств ФБУ «ГИЛС и НП» Наталья Попова, исполнительный директор ассоциации АВФАРМ Семен Жаворонков и исполнительный директор ассоциации НВА Тимур Чибиляев.
Многие участники присоединились к круглому столу онлайн. Для представителей французских организаций участие в данном мероприятии является важным и уже традиционным, так как это дает возможность сохранения и углубления международного сотрудничества в области обеспечения и контроля качества ветеринарных препаратов. Среди участников была Мари-Аньес Амос (Marie-Agnès Amos), заместитель советника по сельскому хозяйству, референт по ветеринарным, санитарным и фитосанитарным вопросам по России, Казахстану, Беларуси, Армении, Узбекистану, Таджикистану и Кыргызстану Экономической службы Посольства Франции в России.
В октябре Москве прошла IV Международная конференция «Логистика лекарственных средств» [22]. Эта ежегодная конференция может быть интересна производителям ветеринарных препаратов уже потому, что в сентябре 2022 года на федеральном портале проектов нормативных правовых актов (https://regulation.gov.ru/) для публичного обсуждения был размещен проект Приказа Минсельхоза России «Об утверждении Правил надлежащей дистрибьюторской практики лекарственных препаратов для ветеринарного применения» [23]. Если документ будет одобрен, то он вступит в силу 1 сентября 2023 года и будет действовать до 12 марта 2024 г.
На конференции Елена Зелинская (директор по качеству, «Фарма Капитал») выступила с презентацией на тему «Гармонизация классификаций несоответствий». Она отдельно остановилась на документе PIC/S PI 040-1 «Руководство по классификации несоответствий требованиям GMP» (Guidance on Classification of GMP Deficiencies), целью которого является гармонизация классификаций несоответствий и обеспечение согласованности между инспекциями [24].
Всем участникам конференции сообщество руководителей и специалистов по логистике и качеству SCM Pharm подарило Сборник практических статей GDP Review 3. Среди представленных в сборнике материалов можно отметить статью «Проведение дистанционных GMP инспекций» (Евгений Гладышев, старший менеджер, международное качество и дистрибьюция, «Амджен» и Юлия Степанова, менеджер, международное качество и дистрибьюция, «Амджен»). Авторы статьи отмечают, что виртуальные инспекции имеют ряд ограничений, занимают больше времени и, соответственно, требуют тщательной подготовки со стороны Заявителя и производителя. Важная роль во время подготовки и проведения инспекции отводится IT-специалистам: необходимо обеспечить беспрепятственную коммуникацию и организовать онлайн-трансляции. Эффективность и успешность инспекции с использованием средств дистанционного взаимодействия зависит в том числе от качества и уровня используемых информационных технологий. Ключевыми элементами, которые следует учитывать при подготовке к инспекции, помимо технической осуществимости, являются безопасность и конфиденциальность удаленных подключений. Необходимо заранее проработать возможные юридические проблемы и запросы на выполнение видеозаписей и предоставление документации на электронных носителях. Следует определить, согласовать и установить безопасные пути для обмена документацией и передачи файлов. Рекомендуется заранее, до начала инспекции, провести предварительное тестирование доступа к информационным системам для видеосвязи и обмена документацией.
Производителям лекарственных препаратов нужно следить за информацией, которую публикуют регуляторные органы и отраслевые организации, и быть готовыми к любому виду инспектирования. В одной из октябрьских публикаций на портале «Зооинформ» [25], отмечается, что проводимые в настоящее время дистанционные инспекции не так просты: требуется бесшовное интернет-покрытие на всей площадке, больший объем документов на перевод, может возникать критичная разница в часовых поясах и т. п.
На заметку:
Согласно «Методическим рекомендациям по подготовке к дистанционной инспекции иностранного производителя лекарственных средств для ветеринарного применения», подготовленным ФГБУ «ВГНКИ» [16, 17], для удаленного анализа площадка может предоставить инспекторам как видеозаписи с камеры в реальном времени, так и видеозаписи. П. 2.4 документа Европейского агентства по лекарственным средствам EMA/335293/2020 «Руководство по GMP/GDP и PMF дистанционным оценкам» (Guidance related to GMP/GDP and PMF distant assessments) также говорит о возможности предоставить видеозаписи с камеры в реальном времени или видеозаписей [26]. Необходимо учесть, что слишком продолжительные по времени видеозаписи могут создавать дополнительные проблемы во время видеоконференции, особенно в случае неустойчивого интернет-соединения. Некоторые рукописные документы (такие как записи, журналы и пр.) можно продемонстрировать с помощью документ-камеры — специального видеооборудования на штативе, которое позволяет получить четкое изображение любых объектов и транслировать его на экран в режиме реального времени. О необходимости заказать перевод документов площадки заранее некоторые производители почему-то не думают. В соответствии с условными нормативами объема работы переводчиков, за день профессиональный переводчик может перевести примерно 6-10 страниц текста (если принять за расчетную единицу стандартную страницу, равную 1800 печатным символам или 250 словам). Именно такое количество страниц вполне реально перевести в течение рабочего дня на достойном уровне качества. Это нужно учитывать при планировании сроков перевода документации для инспекции.
О подготовке к дистанционному инспектированию можно также прочитать здесь.

В октябре прошла деловая встреча исполнительного директора Евразийской академии надлежащих практик Ирины Спичак и заместителя директора ФГБУ «ВГНКИ» Данила Рудняева. В ходе встречи обсуждались актуальные тренды отраслевого образования, а также вопросы сотрудничества организаций, в частности перспективы использования VR-завода Академии для инспектората «ВГНКИ» [27].
Симуляционный виртуальный фармацевтический комплекс «Виртуальный завод 2.0» — уникальный продукт на основе технологий виртуальной реальности, созданный для отработки навыков инспектирования производства лекарственных средств на соответствие стандартам GMP. Пользователь системы имеет возможность пройти все этапы реальной инспекции фармацевтического завода твердых форм, начиная от прибытия на территорию предприятия и встречи с сотрудниками и заканчивая полным осмотром производственных помещений и оборудования. Аппаратная часть системы представляет из себя комплект, состоящий из персонального компьютера с установленным программным обеспечением, очков виртуальной реальности и контроллеров для управления. При использовании тренажера изображение из VR-очков может транслироваться на внешний телеэкран или проектор, позволяя таким образом наблюдать за происходящим куратору или большой аудитории зрителей [28].
Во второй половине 2022 года на платформе Академии прошла серия бесплатных вебинаров в рамках программы дополнительного профессионального образования. Например, в августе состоялся вебинар на тему «Управление отклонениями и САРА. OOS/OOT/OOE», в сентябре — по теме «Обеспечение целостности данных в процессах производства лекарственных препаратов», в октябре — на тему «Основы валидации компьютеризированных систем» [29, 30].
Среди новых образовательных проектов для специалистов фармацевтических компаний можно отметить Учебный Центр «ДжиЭксПи».
В октябре Учебный Центр провел бесплатный вебинар по теме «Зона ответственности Уполномоченных лиц производителя лекарственных средств. Кто несет ответственность за качество?». Среди вопросов, которые были заданы во время проведения вебинара, был вопрос о требованиях, которые предъявляются к уполномоченным лицам. Из полученного ответа видна разница в требованиях к трудовому стажу у производителей лекарственных средств для медицинского и ветеринарного применения [31]. В соответствии с «Порядком аттестации уполномоченных лиц производителей лекарственных средств», утвержденным Решением Совета ЕЭК от 03.11.2016 г. № 73 [32], аттестуемое уполномоченное лицо должно иметь не менее 3 лет трудового стажа в области производства, или обеспечения качества, или контроля качества лекарственных средств. Cогласно «Порядку аттестации уполномоченного лица производителя лекарственных средств для ветеринарного применения», утвержденному Приказом Минсельхоза России от 22.10.2021 г. № 720 [33], который вступит в силу с 1 марта 2024 года, к аттестации будут допускаться работники производителей лекарственных средств для ветеринарного применения, имеющие стаж работы не менее 5 лет в области производства и (или) контроля качества лекарственных средств.
На заметку:
Cтаж работы не менее, чем 5 лет в области производства и (или) контроля качества лекарственных средств либо в области мониторинга эффективности и безопасности лекарственных препаратов для ветеринарного применения, будет также требоваться согласно новому «Порядку аттестации лица, уполномоченного держателем или владельцем регистрационного удостоверения лекарственного препарата для ветеринарного применения», утвержденному Приказом Минсельхоза России от 10.11.2022 г. № 795 [34]. При этом аттестуемые лица должны будут пройти тестовый контроль знаний, предусматривающий выполнение тестовых заданий в течение 120 минут. Тестовые задания включают в себя 50 вопросов, касающихся требований Правил GMP, а также требований к регистрационному досье на лекарственный препарат для ветеринарного применения. В пределах времени, отведенного на тестовый контроль знаний, невозможно использование аттестуемыми лицами нормативных правовых актов, справочной литературы (в бумажном виде или на электронном носителе) — не допускается использование справочной литературы, письменных заметок, нельзя пользоваться мобильной связью, фото-, аудио- и видеоаппаратурой. В соответствии с частью 2 статьи 52.2 Федерального закона от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств», внесенной Федеральным законом от 02.07.2021 г. № 317-ФЗ [35], перед вводом в гражданский оборот каждой серии ввозимого в Российскую Федерацию лекарственного препарата для ветеринарного применения, осуществляющая ввоз организация должна будет представить в Россельхознадзор подтверждение соответствия лекарственного препарата требованиям, установленным при его государственной регистрации, от лица, уполномоченного держателем или владельцем регистрационного удостоверения лекарственного препарата для ветеринарного применения. На настоящий момент времени такой порядок подтверждения соответствия отсутствует (в отличие от порядка подтверждения соответствия, выполняемого уполномоченным лицом, который установлен Приложением 16 к Правилам GMP ЕАЭС, утвержденным Решением Совета ЕЭК от 03.11.2016 г. № 77 [20]).
По объективным причинам в 2022 году прошли не все планируемые мероприятия. Например, запланированная в Санкт-Петербурге Ежегодная конференция ISPE ЕАЭС была перенесена на 2023 г. Как написано на сайте Евразийского отделения ассоциации, сильная сторона подобных мероприятий — это межстрановое и межрегиональное освещение ключевых проблем и аспектов развития фармацевтической промышленности, но в текущих условиях данный аспект серьезно сокращается [36].
Тем не менее в некоторых международных мероприятиях можно было принять участие дистанционно. Например, очень информационным был бесплатный вебинар «Annex 1 — what it means for you», организованный в октябре французской компанией Elis и посвященный новому Приложению 1 к EU GMP [37]. Это приложение будет введено в действие в Европейском Союзе в августе 2023 года. Как недавно отметил ведущий специалист по валидации PQE Group Александр Белинский, без постоянного общения и обучения знания устаревают. В новом Приложении, посвященном производству стерильных лекарственных средств, есть много новой информации, новых подходов и регуляторных требований, которые с минимальными правками, скорее всего, будут внедрены в ЕАЭС [38].
В декабре можно было принять участие в бесплатном вебинаре «Approaches for Pharmaceutical Supplier Qualification», проведенном индийской компанией Pharmazone. На вебинаре были разобраны такие моменты как необходимость оценки, тип и способ оценки, применимые руководства и проблемы с квалификацией поставщиков. Тема квалификации поставщиков материалов и поставщиков услуг очень важна. Например, в 2019 году в «Перечнь наиболее часто встречающихся несоответствий при инспектировании производителей лекарственных средств для ветеринарного применения» было включено следующее несоответствие — не осуществляется контроль деятельности, передаваемой на аутсорсинг.
Вызовы в 2023 году
Во время интервью федеральному отраслевому изданию «Ветеринария и жизнь» директор ФГБУ «ВГНКИ» Леонид Киш обратил внимание на то, что с 1 сентября 2023 года вступает в силу изменения в Федеральный закон от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств», внесенные Федеральным законом от 02.07.2021 г. № 317-ФЗ [35], и те компании (в основном иностранные), которые не будут соответствовать стандарту GMP, не смогут реализовать свои препараты на территории Российской Федерации [39].
В интервью тому же федеральному отраслевому изданию исполнительный директор ассоциации АВФАРМ Семен Жаворонков рассказал о том, что международные компании, как и ранее, работают на российском рынке, а российские команды прикладывают сейчас все силы, чтобы, несмотря на санкционные ограничения и логистические сложности, выполнить обязательства перед потребителями, а также исполнить требования законодательства [40].
В сентябре 2022 года ассоциация АВФАРМ запустила для всех действующих и потенциальных новых участников отрасли раздел с открытыми данными, где опубликован реестр отечественных и зарубежных производственных площадок, которые прошли сертификацию на соответствие требованиям Правил GMP [41]. Этот реестр представляет собой упрощенную версию реестра GMP-заключений на сайте Россельхознадзора [1], однако в нем отсутствует перечень производимых площадкой лекарственных средств для ветеринарного применения. Следует также иметь в виду, что процесс производства и контроля качества некоторых препаратов может быть распределен между несколькими производственными площадками, которые выполняют отдельные стадии.
По состоянию на конец уходящего года зарубежные производители имеют 26 действующих GMP-заключений, количество которых не увеличивается уже второй год подряд (в начале 2021 года у иностранных производителей было 37 действующих заключений).
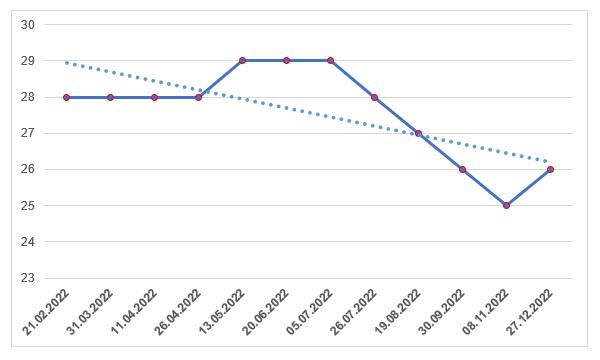
Такая ситуация не может не беспокоить иностранных производителей ветеринарных препаратов, так как до сентября следующего года осталось всего восемь месяцев, в течение которых требуется получить GMP-заключение. Поэтому в 2023 году стоит ожидать увеличение количества инспекций производителей лекарственных препаратов для ветеринарного применения, в отличие от производителей лекарственных препаратов для медицинского применения, у которых в ближайшие два года ожидается снижение количества инспекций [42].
В соответствии с графиком проведения инспектирования, опубликованном на сайте Россельхознадзора 27.12.2022 г. [43], на 2023 год запланировано 33 инспекции производителей ветеринарных препаратов, площадки которых расположены в Австралии, Австрии, Бельгии, Бразилии, Венгрии, Германии, Испании, Италии, Китае, Нидерландах, Новой Зеландии, Румынии, США, Франции, Чехии и Эстонии. Больше всего инспекций (7) должно пройти в отношении производственных площадок, расположенных во Франции.
Производителям рекомендуется принимать активное участие в событиях и мероприятиях, связанных с GM(D)P, и тщательнее готовиться к инспектированию.
Представленный материал подготовлен с использованием данных, актуальных на 27.12.2022. В случае получения новых или дополнительных данных статья может быть обновлена.
***
Федеральное государственное бюджетное учреждение «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов», ФГБУ «ВГНКИ» — учреждение, уполномоченное на проведение инспектирования производителей лекарственных средств для ветеринарного применения, производство которых осуществляется за пределами Российской Федерации, на соответствие требованиям Правил GMP
Федеральное бюджетное учреждение «Государственный институт лекарственных средств и надлежащих практик», ФБУ «ГИЛС и НП» — учреждение, уполномоченное на проведение инспектирования производителей лекарственных средств для медицинского применения, производство которых осуществляется за пределами Российской Федерации, на соответствие требованиям Правил GMP
Государственное учреждение «Белорусский государственный ветеринарный центр» — учреждение Республики Беларусь, уполномоченное на проведение фармацевтических инспекций производства ветеринарных лекарственных средств на соответствие требованиям Правил GMP
Французское агентство по ветеринарным лекарственным средствам — the Agence Nationale du Médicament Vétérinaire, ANMV. Агентство проводит мониторинг качества реализуемых во Франции лекарственных средств для ветеринарного применения. Кроме того, ANMV выдает разрешения на маркетинг ветеринарных лекарственных средств, осуществляет лицензирование фармацевтических площадок на производство, дистрибьюцию и экспорт
Национальное управление безопасности пищевой цепи, NÉBIH — объединенный уполномоченный орган Венгрии по безопасности пищевых продуктов. NÉBIH отвечает за контроль всей пищевой цепи от фермы до стола, включая защиту почвы, сельскохозяйственное производство, лесное хозяйство, пищевую промышленность, розничную торговлю и общественное питание
Европейское агентство по лекарственным средствам — the European Medicines Agency, EMA. Это агентство Европейского Союза, отвечающее за оценку и надзор за лекарственными средствами
Министерство сельского хозяйства США — the United States Department of Agriculture, USDA. В функции министерства входит исполнение политики в области сельского хозяйства и продовольствия, в том числе продовольственной безопасности, развитие сельских районов, финансирование научных исследований в области сельского хозяйства. USDA проводит проверки производителей иммунобиологических лекарственных средств для ветеринарного применения на территории США
Ассоциация содействия развитию ветеринарного дела «Национальная ветеринарная ассоциация», НВА — ассоциация, объединяющая крупнейших отечественных производителей ветеринарных препаратов
Ассоциация ветеринарных фармацевтических производителей АВФАРМ — ассоциация, представляющая на территории Российской Федерации интересы ведущих международных фармацевтических компаний-производителей лекарственных средств для ветеринарного применения (MSD Animal Health, Elanco, Zoetis и Boehringer Ingelheim)
Ассоциация HealthforAnimals — некоммерческая неправительственная организация, представляющая компании и отраслевые ассоциации из развитых и развивающихся стран (производителей ветеринарных фармацевтических препаратов, вакцин и других продуктов для здоровья животных во всем мире, а также ассоциации, представляющие компании на национальном и региональном уровнях)
Схема сотрудничества фармацевтических инспекций — the Pharmaceutical Inspection Co-operation Scheme, PIC/S. Это не имеющая обязательной силы, неформальная договоренность о сотрудничестве между регулирующими органами в области GMP лекарственных средств для медицинского или ветеринарного применения
Евразийское отделение ISPE, ISPE ЕАЭС — локальное отделение ISPE в Евразийском экономическом союзе, созданное для экспертной поддержки развития надлежащих практик в фармацевтической отрасли на территории ЕАЭС
ССЫЛКИ:
- Россельхознадзор / Деятельность / Госуслуги / Выдача заключения о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики / Дополнительная информация для заявителя / Государственный реестр заключений о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики. URL: https://fsvps.gov.ru/ru/gosuslugi/zaklyuchenie-o-sootvetstvii (дата обращения 12.2022)
- KRKA / КРКА в России / Завод OOO «КРКА-РУС». URL: https://www.krka.biz/ru/krka-v-rossii/predstavleniye/ooo-krka-rus/ (дата обращения 12.2022)
- RNC Pharma / Новости / RNC Pharma представляет информацию относительно активности ввоза ветеринарных ЛП и кормовых добавок в Россию по итогам октября 2022 г. URL: https://rncph.ru/news/30_11_2022 (дата обращения 27.12.2022)
- Россельхознадзор / Новости / Главные новости / Сергей Данкверт принял участие в заседании Общественного совета при Россельхознадзоре. URL: https://fsvps.gov.ru/ru/fsvps/news/47946.html (дата обращения 27.12.2022)
- Ветеринария и жизнь / Зообизнес / Производство российских ветпрепаратов увеличат в 5 раз к 2030 году. URL: https://vetandlife.ru/sobytiya/proizvodstvo-rossijskih-vetpreparatov-uvelichat-v-5-raz-k-2030-godu/ (дата обращения 27.12.2022)
- Электронный фонд правовых и нормативно-технических документов / Федеральный закон от 04.05.2011 г. № 99-ФЗ «О лицензировании отдельных видов деятельности» (редакция, действующая с 1 марта 2022 года). URL: https://docs.cntd.ru/document/902276657 (дата обращения 27.12.2022)
- RTVI / Новости / Производители иностранных ветпрепаратов предупредили об угрозе сокращения импорта в Россию на 85%. URL: https://rtvi.com/news/proizvoditeli-inostrannyh-vetpreparatov-predupredili-ob-ugroze-sokrashheniya-importa-v-rossiyu-na-85/ (дата обращения 27.12.2022)
- ФГБУ «ВГНКИ» / Главная / Пресс-центр / Новости / Специалисты отдела инспекции ФГБУ «ВГНКИ» провели инспектирования производителей лекарственных средств для ветеринарного применения. URL: https://www.vgnki.ru/specialisty-otdela-inspekcii-fgbu-vgnki-proveli-inspektirovaniya-proizvoditelej-leksredstv-dlya-veterinarnogo-primeneniya.html (дата обращения 27.12.2022)
- ФГБУ «ВГНКИ» / Структура / Отдел инспекции производства на соответствие требованиям надлежащей производственной практики / Нормативно-правовая документация / Постановление Правительства РФ от 03.12.2015 N 1314 (ред. от 05.09.2020) «Об определении соответствия производителей лекарственных средств требованиям правил надлежащей производственной практики» (вместе с «Правилами организации и проведения инспектирования производителей лекарственных средств на соответствие требованиям правил надлежащей производственной практики, а также выдачи заключений о соответствии производителя лекарственных средств указанным требованиям»). URL: http://www.vgnki.ru/assets/files/post-1314.pdf (дата обращения 27.12.2022)
- ФГБУ «ВГНКИ» / Пресс-центр / Новости / Итоги работы отдела «Научно-методический базовый центр» за 2022 год. URL: https://www.vgnki.ru/itogi-raboty-otdela-nauchno-metodicheskij-bazovyj-centr-za-2022-god.html (дата обращения 27.12.2022)
- ФГБУ «ВГНКИ» / Главная / Пресс-центр / Новости / В ФГБУ «ВГНКИ» прошел вебинар по специфике производства лекарственных средств для животных. URL: https://www.vgnki.ru/v-fgbu-vgnki-proshel-vebinar-po-specifike-proizvodstva-lekarstvennyh-sredstv-dlya-zhivotnyh.html (дата обращения 27.12.2022)
- VII Всероссийская GMP-конференция с международным участием / Программа. URL: https://gosgmp.ru/download/Programma-Konferentsii-2022.pdf (дата обращения 27.12.2022)
- Евразийский экономический союз / Решение Совета Евразийской экономической комиссии от 21.01.2022 № 1 «О Правилах регулирования обращения ветеринарных лекарственных средств на таможенной территории Евразийского экономического союза. URL: https://docs.eaeunion.org/Pages/DisplayDocument.aspx?s=%7Be1f13d1d-5914-465c-835f-2aa3762eddda%7D&w=9260b414-defe-45cc-88a3-eb5c73238076&l=%7B8a412e96-924f-4b3c-8321-0d5e767e5f91%7D&EntityID=32004 (дата обращения 27.12.2022)
- АВФАРМ / Новости / Результаты и перспективы прохождения инспекций на соответствие GMP ЕАЭС ветеринарными фармацевтическими производителями обсудили на конференции в Иркутске. URL: https://avpharm.ru/news/rezultaty-i-perspektivy-prokhozhdeni/ (дата обращения 27.12.2022)
- Союз предприятий зообизнеса / Новости / Российский инспекторат может проводить 80 инспекций в год. URL: http://www.spzoo.ru/cntnt/default/n7609.html (дата обращения 27.12.2022)
- Россельхознадзор / Деятельность / Госуслуги / Выдача заключения о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики / Дополнительная информация для заявителя / Методические рекомендации по подготовке к дистанционной инспекции иностранного производителя лекарственных средств для ветеринарного применения. URL: https://fsvps.gov.ru/sites/default/files/files/gosuslugi-lek/guid_for_preparing_for_inspection.pdf (дата обращения 27.12.2022)
- ФГБУ «ВГНКИ» / Структура / Отдел инспекции производства на соответствие требованиям надлежащей производственной практики / Полезная информация / Методические рекомендации по подготовке к дистанционной инспекции иностранного производителя лекарственных средств для ветеринарного применения. URL: https://www.vgnki.ru/otdel-inspekcii-proizvodstva-na-sootvetstvie-trebovaniyam-nadlezhashhej-proizvodstvennoj-praktiki.html (дата обращения 27.12.2022)
- Союз предприятий зообизнеса / Новости / Ответы на вопросы производителей на круглом столе «GMP ветеринарных фармацевтических производств: тенденции и перспективы». URL: http://www.spzoo.ru/cntnt/default/n7601.html (дата обращения 27.12.2022)
- ФАРМПРОМ / Регуляторы фармрынка / Владислав Шестаков: Заявка России о вступлении в членство Схемы PIC/S была заморожена. URL: https://pharmprom.ru/vladislav-shestakov-zayavka-rossii-o-vstuplenii-v-chlenstvo-sxemy-pic-s-byla-zamorozhena/ (дата обращения 27.12.2022)
- Евразийский экономический союз / Решение Совета Евразийской экономической комиссии от 03.11.2016 г. № 77 «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза». URL: https://docs.eaeunion.org/docs/ru-ru/01411921/cncd_21112016_77 (дата обращения 27.12.2022)
- ФГБУ «ВГНКИ» / Структура / Отдел инспекции производства на соответствие требованиям надлежащей производственной практики / Полезная информация / Перечень наиболее часто встречающихся несоответствий при инспектировании производителей лекарственных средств для ветеринарного применения. URL: https://www.vgnki.ru/otdel-inspekcii-proizvodstva-na-sootvetstvie-trebovaniyam-nadlezhashhej-proizvodstvennoj-praktiki.html (дата обращения 27.12.2022)
- SCM Pharm / Мероприятия / IV Международная конференция: Логистика лекарственных средств / Конференция / Программа конференции. URL: https://scmpharm.ru/events/4-offline-conf/ (дата обращения 27.12.2022)
- Федеральный портал проектов нормативных правовых актов / Проект Приказа Минсельхоза России «Об утверждении Правил надлежащей дистрибьюторской практики лекарственных препаратов для ветеринарного применения». URL: http://regulation.gov.ru/p/131144 (дата обращения 12.2022)
- Pharmaceutical Inspection Co-operation Scheme / PIC/S Guidance on Classification of GMP Deficiencies (PI 040-1). URL: https://picscheme.org/docview/2303 (дата обращения 12.2022)
- Зооинформ / Статьи / Рынок зоотоваров / Ненадлежащее регулирование надлежащей практики. URL: https://zooinform.ru/business/articles/nenadlezhashhee-regulirovanie-nadlezhashhej-praktiki/ (дата обращения 27.12.2022)
- EMA / GMP/GDP Inspectors Working Group / Guidance related to GMP/GDP and PMF distant assessments. URL: https://www.ema.europa.eu/en/documents/scientific-guideline/guidance-related-gmp/gdp-pmf-distant-assessments_en.pdf (дата обращения 27.12.2022)
- Евразийская Академия надлежащих практик / Об Академии / Новости и события / 18 октября прошла деловая встреча исполнительного директора Академии Ирины Спичак и замдиректора ФГБУ «ВГНКИ» Данила Рудняева. URL: https://gxp-academy.org/about/news_and_events/1020/ (дата обращения 27.12.2022)
- Симуляционный виртуальный фармацевтический комплекс GxP. URL: https://vrzavod.org/ (дата обращения 27.12.2022)
- Евразийская Академия надлежащих практик / Об Академии / Новости и события / Евразийская Академия надлежащих практик приглашает 10 августа на бесплатный вебинар «Управление отклонениями и САРА. OOS/OOT/OOE». URL: https://gxp-academy.org/about/news_and_events/699/ (дата обращения 27.12.2022)
- Евразийская Академия надлежащих практик / Об Академии / Новости и события / Евразийская Академия надлежащих практик совместно с холдингом «Нацимбио» проводит серию бесплатных вебинаров. URL: https://gxp-academy.org/about/news_and_events/1019/ (дата обращения 27.12.2022)
- ФАРМПРОМ / Фармацевтическое образование / Кто несет ответственность за качество? Ответы на часто задаваемые вопросы. URL: https://pharmprom.ru/kto-neset-otvetstvennost-za-kachestvo-otvety-na-chasto-zadavaemye-voprosy/ (дата обращения 27.12.2022)
- Евразийский экономический союз / Решение Совета Евразийской экономической комиссии от 03.11.2016 г. № 73 «О Порядке аттестации уполномоченных лиц производителей лекарственных средств». URL: https://docs.eaeunion.org/docs/ru-ru/01413885/cncd_21112016_73 (дата обращения 27.12.2022)
- Электронный фонд правовых и нормативно-технических документов / Приказ Министерства сельского хозяйства Российской Федерации от 22.10.2021 № 720 «Об утверждении Порядка аттестации уполномоченного лица производителя лекарственных средств для ветеринарного применения». URL: https://docs.cntd.ru/document/727092847 (дата обращения 27.12.2022)
- Официальный интернет-портал правовой информации / Приказ Министерства сельского хозяйства Российской Федерации от 10.11.2022 № 795 «Об утверждении Порядка аттестации лица, уполномоченного держателем или владельцем регистрационного удостоверения лекарственного препарата для ветеринарного применения». URL: http://publication.pravo.gov.ru/Document/View/0001202211290041 (дата обращения 27.12.2022)
- Электронный фонд правовых и нормативно-технических документов / Федеральный закон от 02.07.2021 г. № 317-ФЗ «О внесении изменений в Федеральный закон «Об обращении лекарственных средств». URL: https://docs.cntd.ru/document/607142404 (дата обращения 27.12.2022)
- ISPE ЕАЭС / Конференция ISPE ЕАЭС / Новости / Изменение дат III Ежегодной Конференции ISPE ЕАЭС. URL: https://conference.ispe.ru/ (дата обращения 27.12.2022)
- The rules governing medicinal products in the European Union — Volume 4 — EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use / Annex 1 — Manufacture of Sterile Medicinal Products. URL: https://health.ec.europa.eu/system/files/2022-08/20220825_gmp-an1_enpdf (дата обращения 27.12.2022)
- А. Тихонова. Непрерывное обучение, актуализация знаний и обмен опытом // ФАРМПРОМ, 2022, № 2. URL: https://pharmprom.ru/farmprom-otraslevoj-zhurnal-onlajn-vypusk-2-2022/ (дата обращения 27.12.2022)
- Ветеринария и жизнь / Главная / Интервью / Гость студии «Ветеринарии и жизни» – директор ФГБУ «ВГНКИ» Леонид Киш. URL: https://vetandlife.ru/sobytiya/gost-studii-veterinarii-i-zhizni-direktor-fgbu-vgnki-leonid-kish/ (дата обращения 27.12.2022)
- Ветеринария и жизнь / Главная / Интервью / Глава АВФАРМ: ассоциация планирует объединить международные фармацевтические компании стран Запада и Востока. URL: https://vetandlife.ru/sobytiya/glava-avfarm-associaciya-planiruet-obedinit-mezhdunarodnye-farmacevticheskie-kompanii-stran-zapada-i-vostoka/ (дата обращения 27.12.2022)
- АВФАРМ / Аналитика / Предприятия с GMP. URL: https://analytics.avpharm.ru/gmp (дата обращения 27.12.2022)
- Фармацевтический вестник / Новости / Производство / ГИЛС ожидает снижение количества зарубежных инспекций. URL: https://pharmvestnik.ru/content/news/GILS-ojidaet-snijenie-kolichestva-zarubejnyh-inspekcii.html (дата обращения 27.12.2022)
- Россельхознадзор / Деятельность / Госуслуги / Выдача заключения о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики / Дополнительная информация для заявителя / График инспектирования производителей. URL: https://fsvps.gov.ru/ru/gosuslugi/zaklyuchenie-o-sootvetstvii (дата обращения 27.12.2022)


